Estequiometria das reações químicas
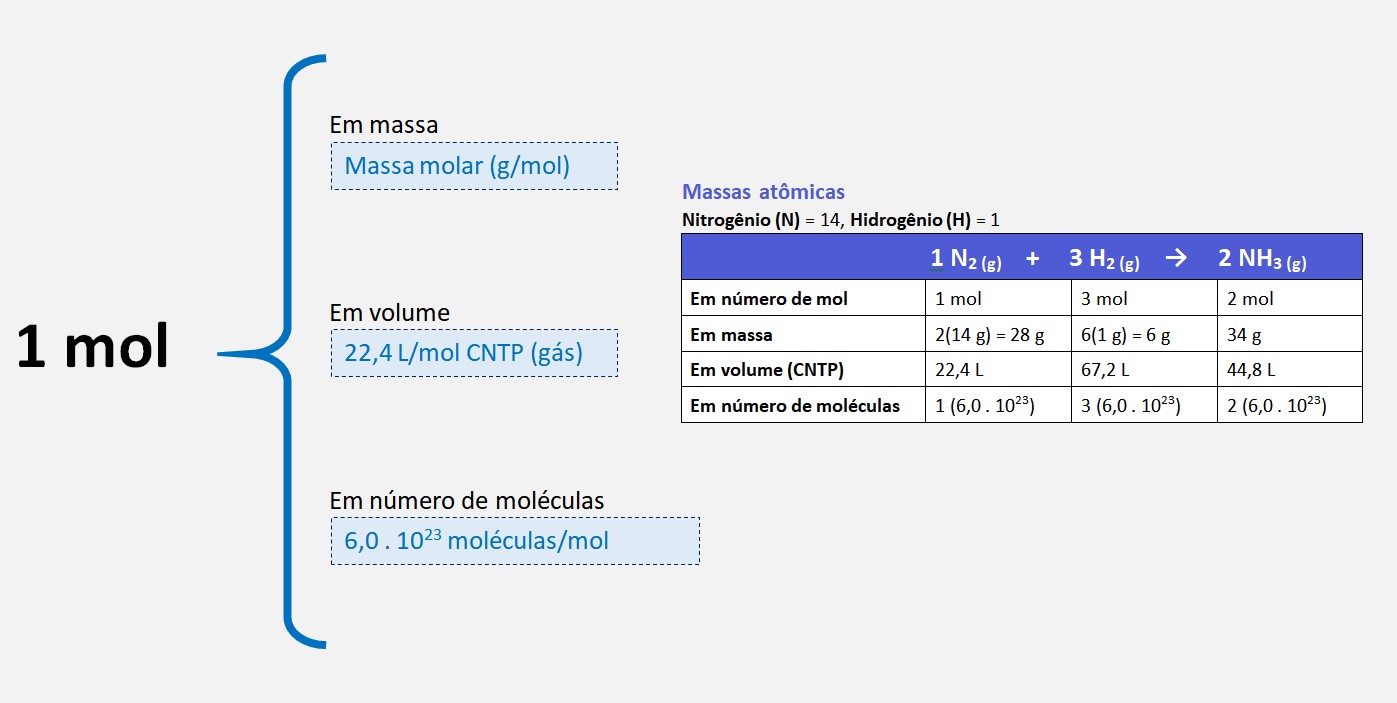
A partir das fórmulas químicas, podemos determinar a relação estequiométrica entre as substâncias na reação. Essa relação estequiométrica é expressa em termos de coeficientes estequiométricos, que indicam a proporção dos reagentes e produtos na reação.
Com base nesses coeficientes, podemos determinar a quantidade de uma substância que será consumida ou produzida em uma reação química. Para isso, utilizamos a relação de proporção entre os reagentes e produtos e a massa molar das substâncias.
Além de determinar a quantidade de substâncias envolvidas em uma reação, a estequiometria também permite calcular outras grandezas, como o volume dos gases envolvidos na reação, a partir da equação química balanceada.
Para realizar cálculos estequiométricos, é importante lembrar alguns passos básicos:
1. Escreva a equação química balanceada para a reação em questão.
2. Utilizando os coeficientes estequiométricos da equação química, estabeleça a relação de proporção entre as substâncias.
3. Determine a massa molar de cada substância envolvida na reação.
4. Utilize a relação estequiométrica para calcular a quantidade de substância desejada.
É importante ressaltar que os cálculos estequiométricos são baseados em um suposto rendimento de 100% da reação, ou seja, considera-se que todos os reagentes sejam totalmente consumidos e todos os produtos sejam totalmente formados. Na prática, esses rendimentos podem variar e o resultado obtido nos cálculos pode diferir do que acontece experimentalmente.
No entanto, a estequiometria é uma ferramenta essencial para determinar as quantidades corretas de reagentes e produtos em uma reação química, permitindo um melhor controle e planejamento das reações. É uma parte fundamental do estudo da química e é aplicada em diversas áreas, como na indústria química, na produção de medicamentos, na alimentação, entre outras.
Em resumo, a estequiometria é a área da química que estuda as proporções das substâncias em uma reação química. Ela permite determinar a quantidade de substâncias envolvidas em uma reação e realizar cálculos para obter informações importantes sobre a reação. É uma ferramenta fundamental para entender e manipular as reações químicas de forma precisa e eficiente.
Exemplos:
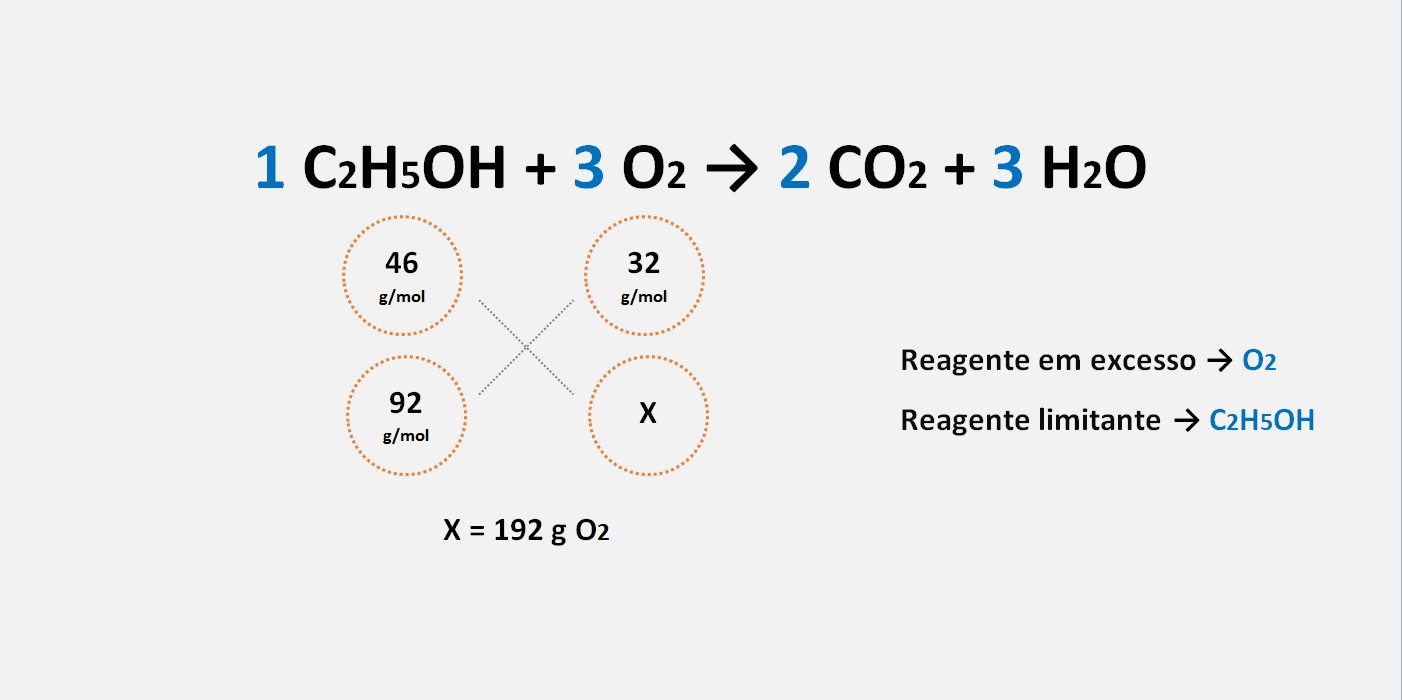
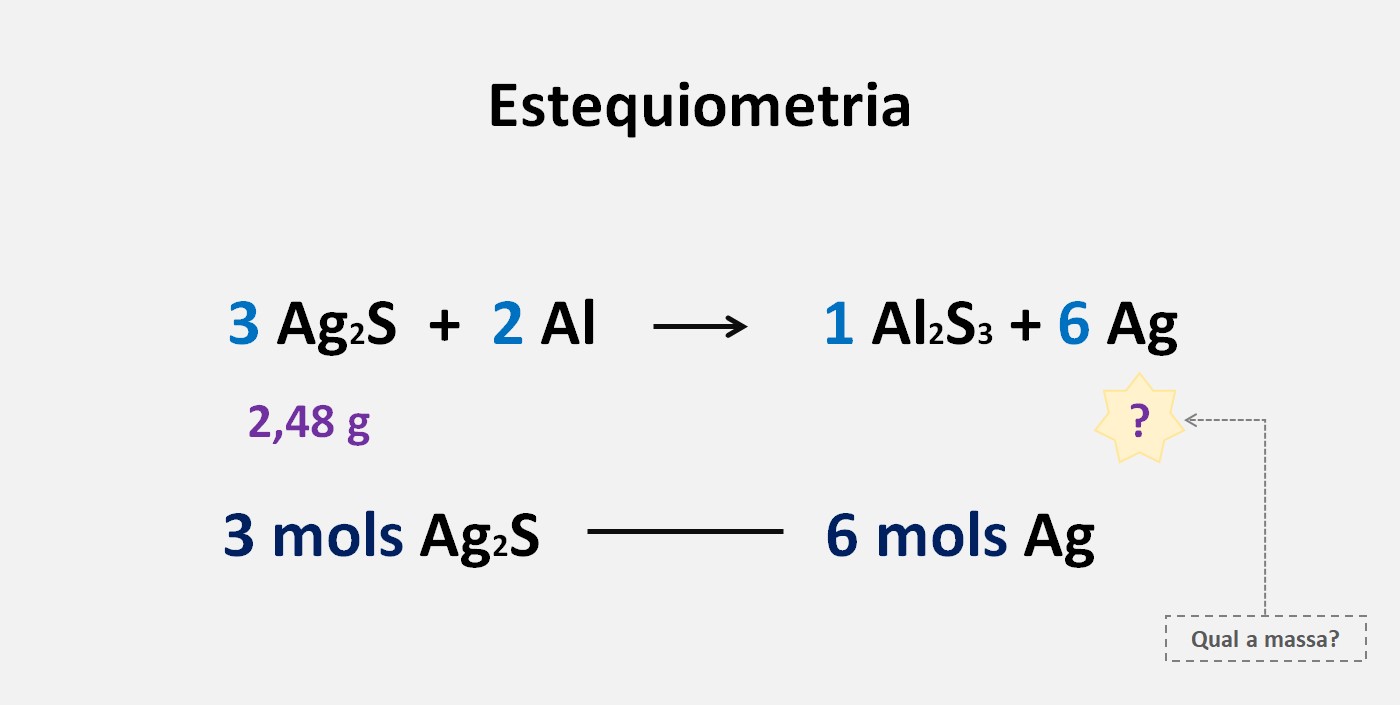
Qual a massa da prata metálica regenerada na superficie que contem 2,48 g de Ag2S?Massa do Ag: 108 e S: 32
1. Escreva a equação química balanceada para a reação em questão.
2. Utilizando os coeficientes estequiométricos da equação química, estabeleça a relação de proporção entre as substâncias.
3 mols de Ag2S(s) — 6 mols de Ag
(simplificando)
1 mols de Ag2S(s) — 2 mols de Ag
3. Determine a massa molar de cada substância envolvida na reação.
1 mols de Ag2S(s) — 2 mols de Ag
(2 . 108)+ 32 — 2 . (108)
248 g 216 g
4. Utilize a relação estequiométrica para calcular a quantidade de substância desejada.
2,48 g de Ag2S(s) — X
248 . X = 535,68
X = 535,68/248
X = 2,16 g
Resposta: 2,16 g de Ag