Lei de Lavoisier (conservação da massa)
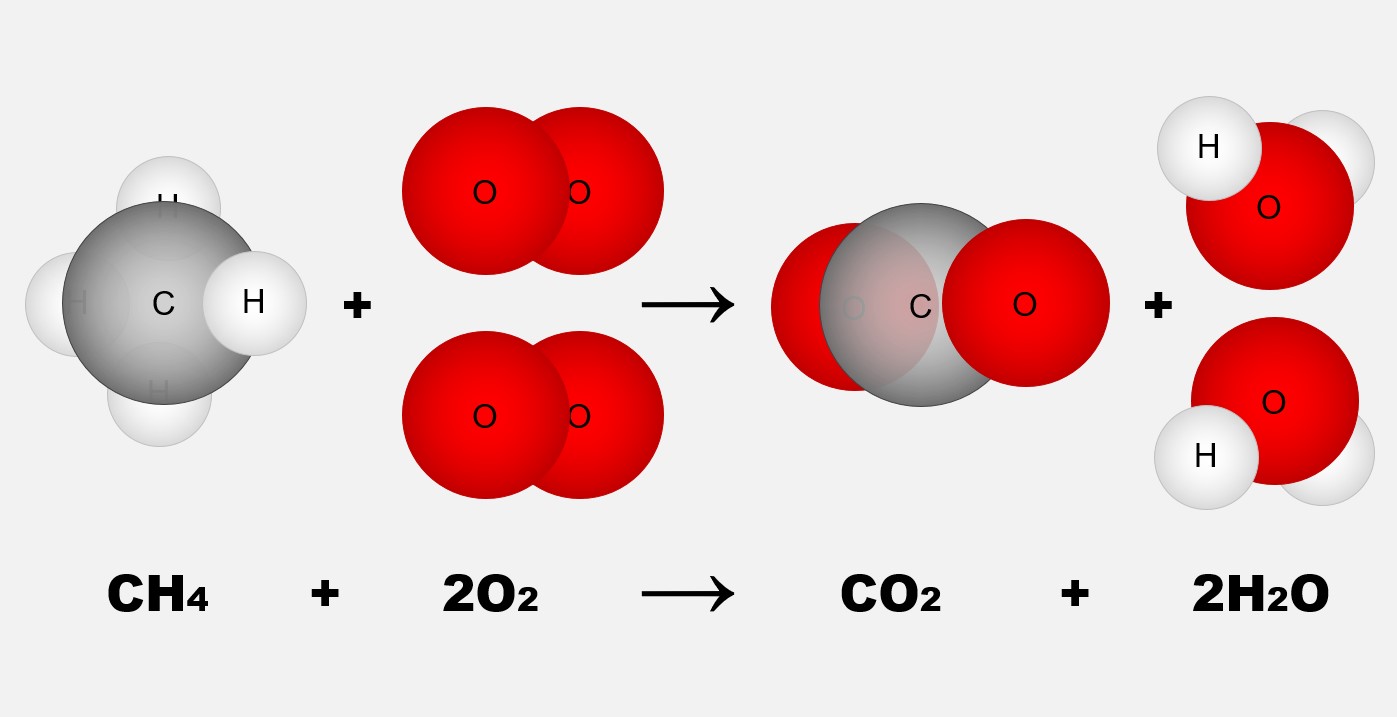
Lavoisier observou experimentalmente que a massa total dos reagentes em uma reação química é igual à massa total dos produtos formados. Esse princípio é conhecido como a Lei da Conservação da Massa. Esse experimento foi uma das bases para a formulação da teoria atômica por Dalton. Dalton propôs que a matéria é formada por átomos, que são partículas indivisíveis e que não podem ser criados ou destruídos durante uma reação química.
Isso significa que o número total de átomos de cada elemento envolvido na reação deve permanecer constante antes e depois da reação. Essas observações e conclusões de Lavoisier e Dalton foram fundamentais no estabelecimento das bases da química moderna. Eles ajudaram a entender que as reações químicas ocorrem devido à reorganização dos átomos, em que as ligações entre eles são quebradas e formadas para criar novas substâncias.