Reagente em excesso e reagente limitante
Reagente em excesso é o reagente que não é completamente consumido na reação química e sobra após a reação atingir o equilíbrio. Ele está presente em quantidade maior do que o necessário para reagir completamente com o outro reagente.
Reagente limitante, por outro lado, é o reagente que determina a quantidade máxima de produto que pode ser formada na reação química. É o reagente que está presente em quantidade menor em relação ao outro reagente, impedindo que ele seja consumido totalmente. A quantidade de produto formada está diretamente relacionada à quantidade de reagente limitante disponível.
Exemplo:
Qual reagente limitante e reagente em excesso?
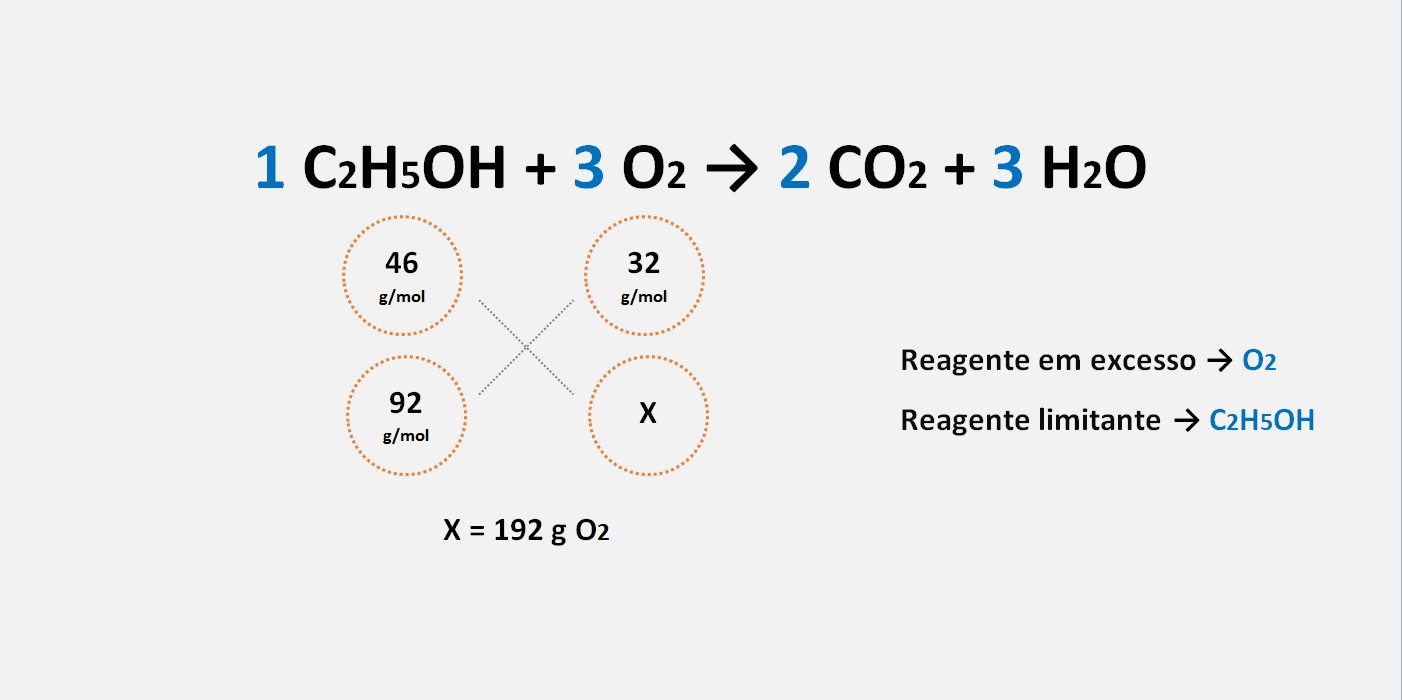
C2H5OH = 92 g, O2 = 240 g.
Dados: M.M.: C2H5OH = 46 g/mol, O2 = 32 g/mol.
C2H5OH + O2 → CO2 + H2O
(balaceamento da equação)
1 C2H5OH + 3 O2 → 2 CO2 + 3 H2O
1 mol de C2H5OH + 3 mol de O2 → 2 mol de CO2
(proporção estequiométrica)
46 g de C2H5OH ——————— 96 g de O2
92 g de C2H5OH ——————— x de O2
X = 192 g de CO2
Reagente em excesso: O2
Reagente limitante: C2H5OH