Eletronegatividade

A Escala de Eletronegatividade de Pauling é uma das escalas mais utilizadas para medir a eletronegatividade dos elementos químicos. Ela foi proposta pelo químico Linus Pauling em 1932 e é baseada em várias propriedades químicas dos elementos, como afinidade eletrônica e energia de ionização.
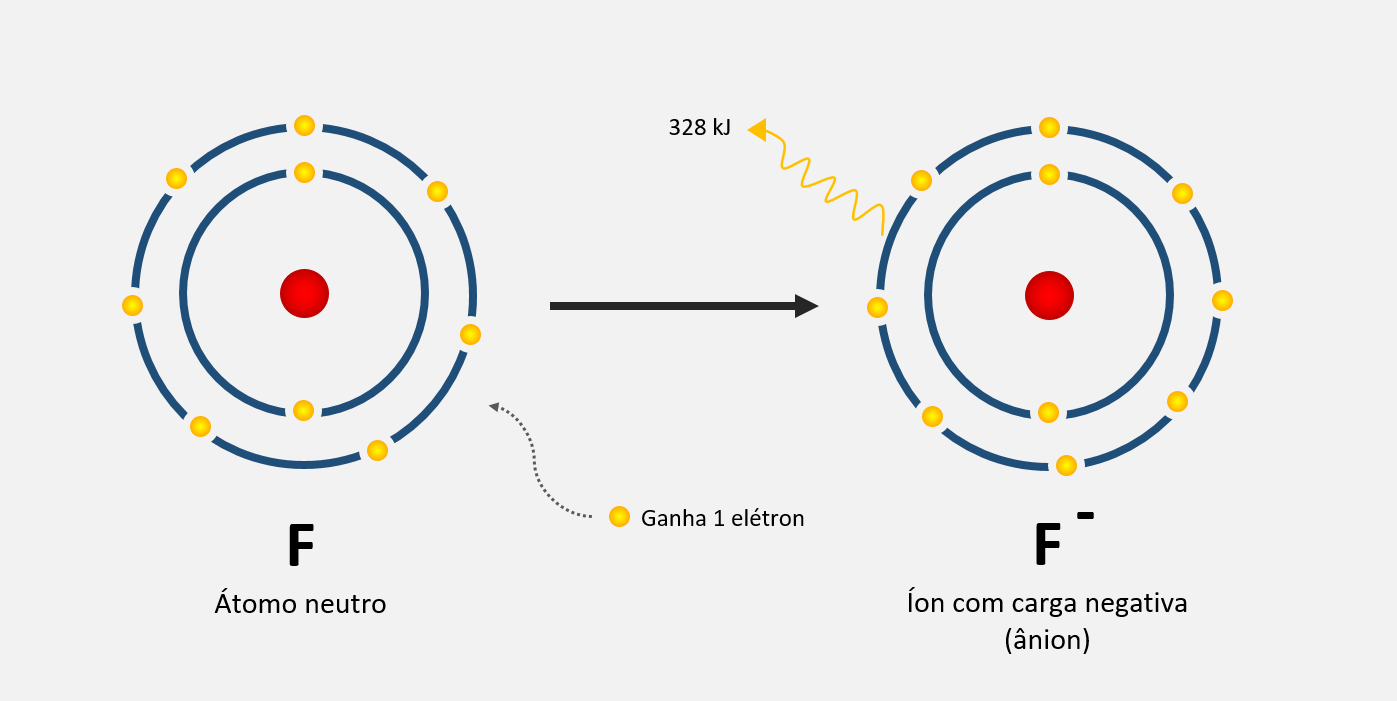
A eletronegatividade é uma propriedade intrínseca dos átomos que mede a sua capacidade de atrair elétrons em uma ligação química covalente. Essa propriedade influencia a forma como os átomos compartilham os elétrons na formação de uma molécula.
Quando dois átomos formam uma ligação covalente, eles compartilham um ou mais pares de elétrons. No entanto, nem sempre o compartilhamento é igualitário, e a eletronegatividade é usada para determinar qual átomo possui maior capacidade de atrair os elétrons.
A diferença na eletronegatividade entre dois átomos em uma ligação covalente determina o caráter da ligação. Se a diferença for pequena, a ligação é considerada covalente não polar, pois os elétrons são compartilhados igualmente. Se a diferença for maior, a ligação é covalente polar, pois os elétrons são atraídos com mais força por um dos átomos, criando uma distribuição de cargas parciais positivas e negativas na molécula.
A eletronegatividade também está relacionada a outras propriedades e comportamentos químicos dos elementos. Por exemplo, ela influencia a solubilidade das substâncias, a capacidade de formar ligações iônicas ou covalentes, bem como a acidez ou basicidade de compostos químicos.
Em resumo, a eletronegatividade é uma propriedade que mede a capacidade de um átomo atrair elétrons em uma ligação química covalente. Ela determina o caráter da ligação, seja ela covalente não polar ou polar. A eletronegatividade também está relacionada a diversas propriedades químicas dos elementos.
- Flúor (F): 3.98
- Oxigênio (O): 3.44
- Nitrogênio (N): 3.04
- Cloro (Cl): 3.16
- Carbono (C): 2.55
- Hidrogênio (H): 2.20
- Lítio (Li): 0.98
- Magnésio (Mg): 1.31
- Alumínio (Al): 1.61
- Potássio (K): 0.82
- Cálcio (Ca): 1.00
- Potássio (K): 0,8
- Cálcio (Ca): 1,0
- Magnésio (Mg): 1,2
- Alumínio (Al): 1,5
- Berílio (Be): 1,5
- Lítio (Li): 1,0
- Césio (Cs): 0,7
Esses são apenas alguns exemplos de elementos e seus respectivos valores de eletronegatividade. É importante destacar que esses valores são relativos e podem variar dependendo da escala usada. A escala de eletronegatividade de Pauling é uma das mais utilizadas, mas existem outras escalas que podem apresentar pequenas diferenças nos valores.