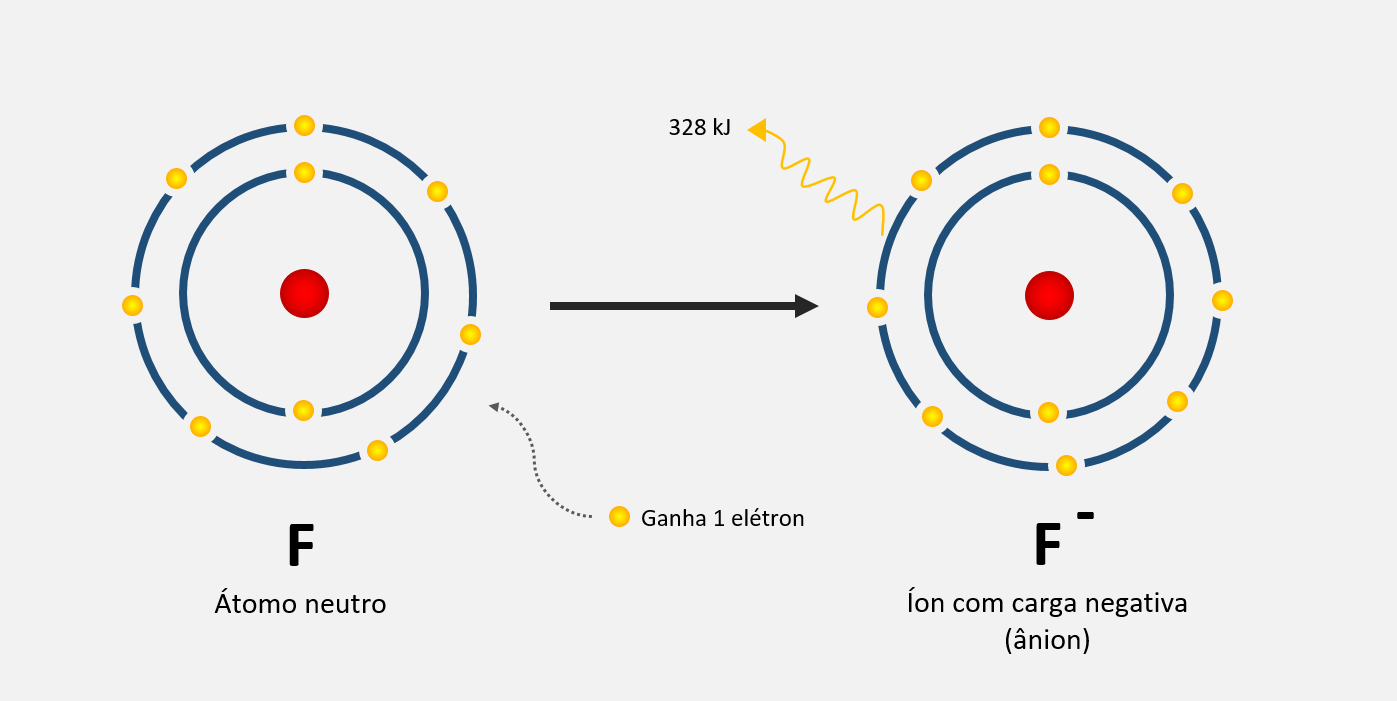
O que é raio atômico?
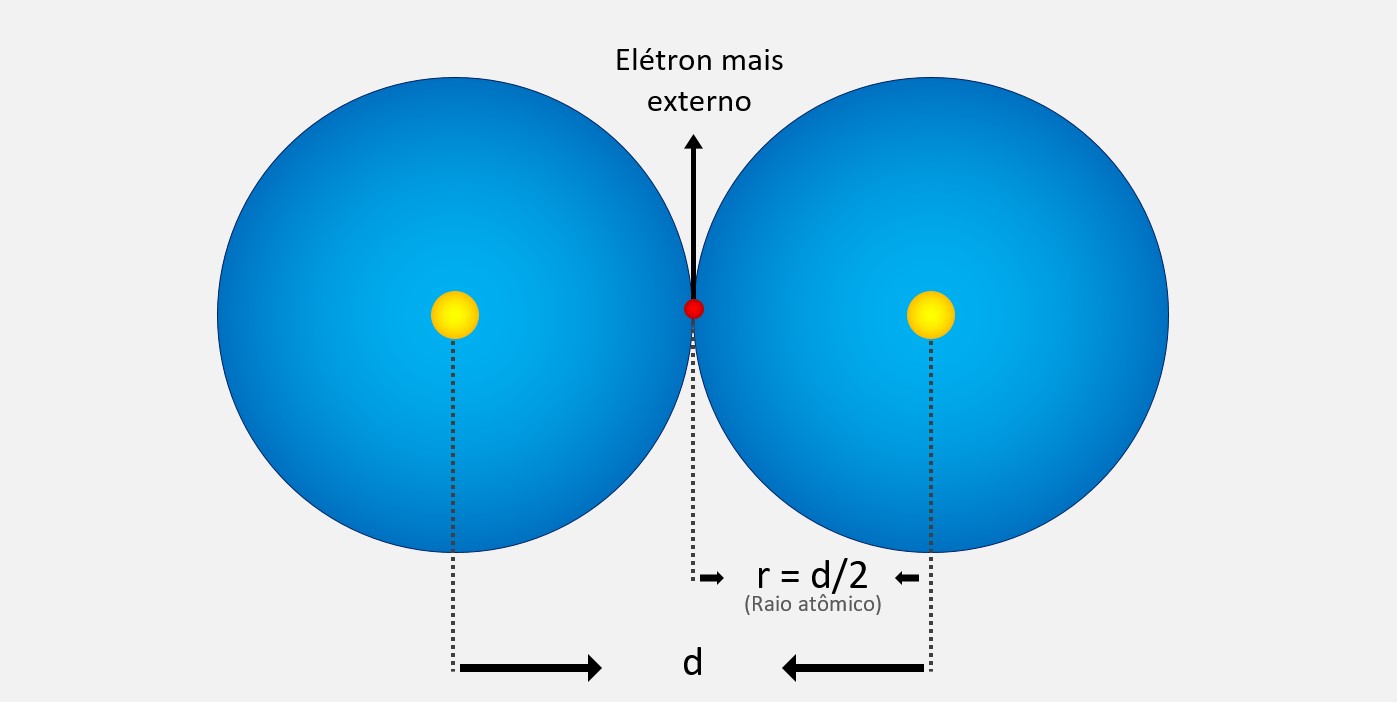
O raio atômico é a medida do tamanho do átomo. Ele é definido como a distância média entre o núcleo do átomo e a camada mais externa de elétrons. O raio atômico geralmente aumenta da direita para a esquerda e de cima para baixo na tabela periódica, devido a fatores como o número de camadas eletrônicas e a atração entre o núcleo e os elétrons. O raio atômico é importante para entender as propriedades químicas e físicas dos elementos.
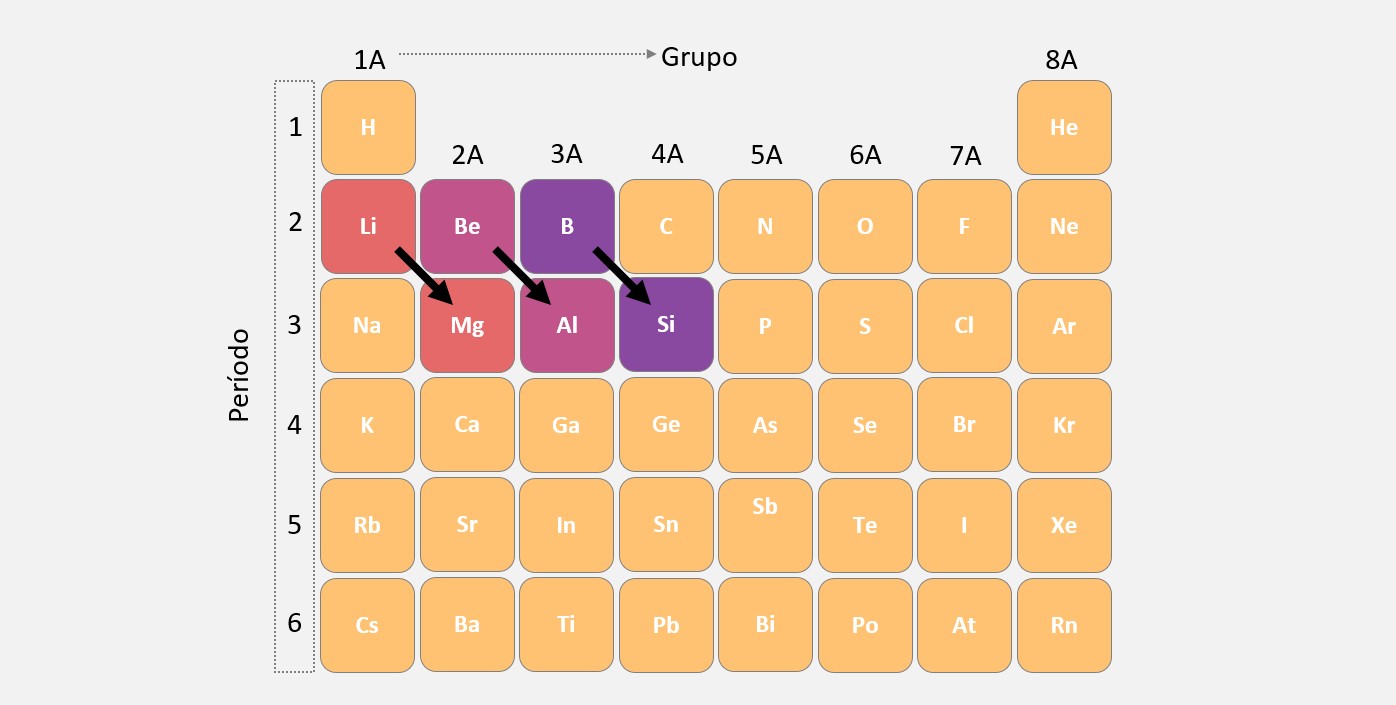
Na mesma família (grupo) da tabela periódica, o número de níveis (camadas) dos átomos aumenta de cima para baixo. À medida que mais camadas são adicionadas, o átomo se torna maior. Isso acontece porque os elétrons ficam distribuídos em órbitas cada vez mais afastadas do núcleo, resultando em um maior raio atômico. Por exemplo, na família dos halogênios (grupo 17), o raio atômico aumenta do flúor para o iodo, devido ao acréscimo de camadas eletrônicas.
Em um mesmo período (linha) da tabela periódica, os átomos apresentam o mesmo número de níveis (camadas eletrônicas). À medida que o número de prótons aumenta, a carga nuclear também aumenta, o que resulta em uma maior atração entre o núcleo do átomo e os elétrons. Essa atração mais forte puxa os elétrons para mais perto do núcleo, fazendo com que o raio atômico diminua. Portanto, de forma geral, ocorre uma diminuição no tamanho dos átomos ao longo de um mesmo período.
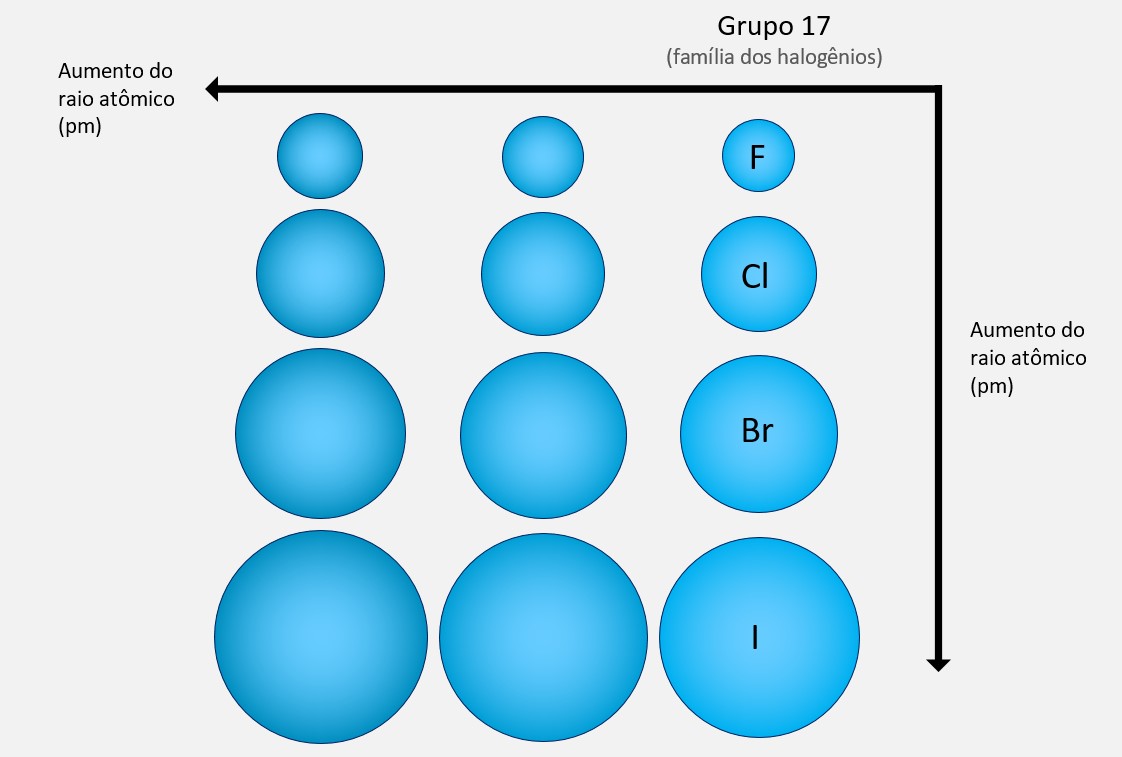
O raio atômico é geralmente expresso em picômetros (pm), que é uma unidade de comprimento equivalente a 10-12 metros. Isso ocorre porque os átomos têm dimensões extremamente pequenas e o picômetro é uma escala apropriada para expressar essas medidas. Então, quando se fala do tamanho de um átomo, é comum utilizar os picômetros como unidade de medida.