Famílias da tabela periódica
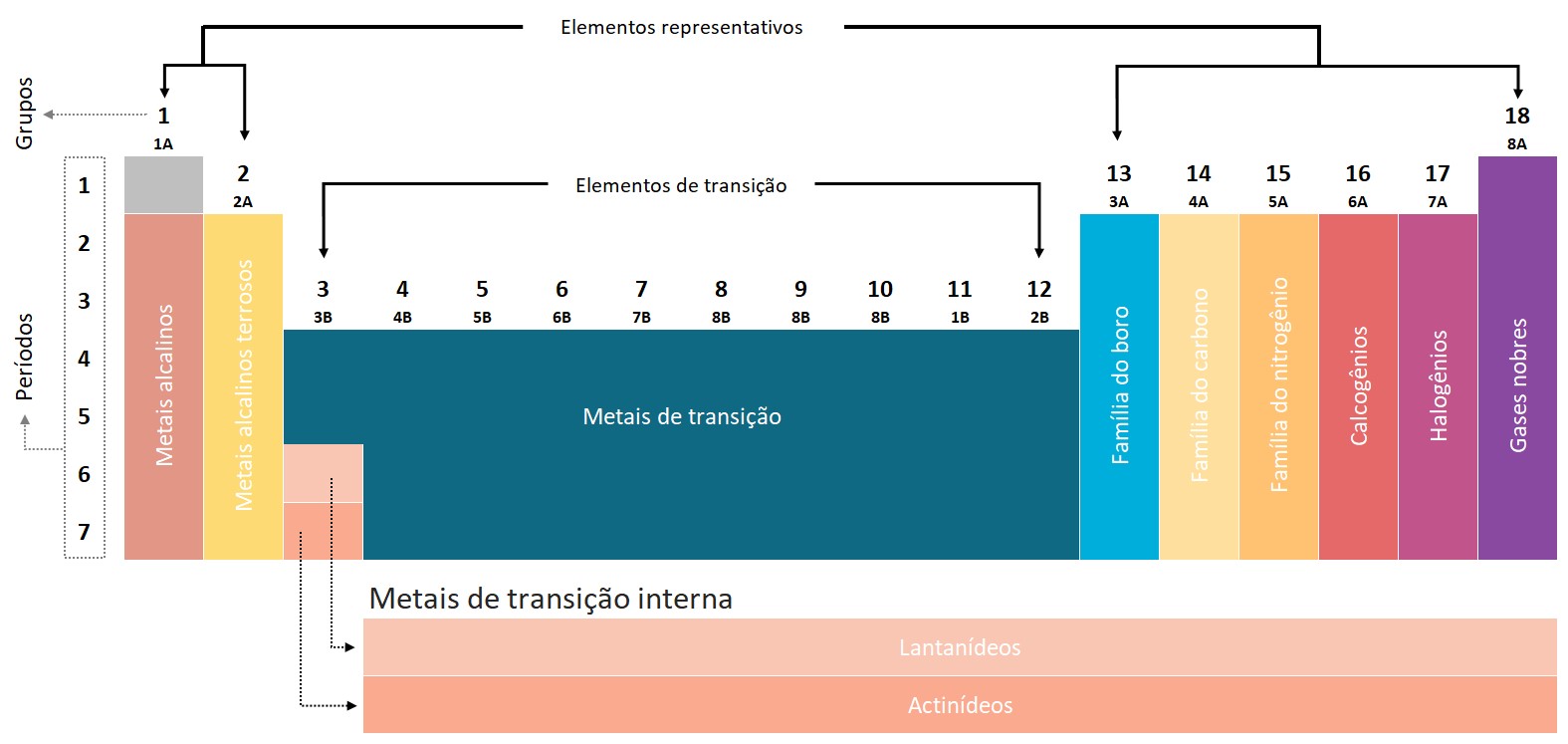
As famílias apresentam elementos químicos com propriedades semelhantes devido à sua configuração eletrônica. A configuração eletrônica determina a disposição dos elétrons ao redor do núcleo do átomo e influencia diretamente as propriedades químicas do elemento.
As famílias na tabela periódica são divididas em grupos principais e grupos de transição. Os grupos principais são numerados de 1 a 18, enquanto os grupos de transição são numerados de 3 a 12.
Dentre as famílias mais comuns na tabela periódica, podemos destacar:
- Família 1 (Grupo 1): Metais Alcalinos, composta pelos elementos lítio, sódio, potássio, rubídio, césio e frâncio. Esses elementos possuem uma valência de 1 e são bastante reativos.
- Família 2 (Grupo 2): Metais Alcalino-Terrosos, composta pelos elementos berílio, magnésio, cálcio, estrôncio, bário e rádio. Esses elementos possuem uma valência de 2 e também são reativos, porém menos reativos do que os metais alcalinos.
- Família 3-12 (Grupos de Transição): Essa família inclui elementos de transição, como os metais de transição e metais de transição interna. Esses elementos têm propriedades metálicas, como alta condutividade elétrica e térmica, e são frequentemente usados em aplicações industriais e tecnológicas.
- Família 13 (família do boro): É composta pelos elementos boro (B), alumínio (Al), gálio (Ga), índio (In) e tálio (Tl). Esses elementos são parte do grupo dos metais, mais especificamente dos metais terrosos ou metais representativos.
-Família 14 (família do carbono): é composta pelos elementos carbono (C), silício (Si), germânio (Ge), estanho (Sn) e chumbo (Pb). Esses elementos são todos não metais, exceto o estanho e o chumbo, que são metais.
- Família 15 (família do nitrogênio ou pnicogênios): É composta pelos elementos nitrogênio (N), fósforo (P), arsênio (As), antimônio (Sb) e bismuto (Bi). Esses elementos são encontrados no quinto período da tabela periódica.
- Família 16 (família do oxigênio ou calcogênios): É composta pelos elementos oxigênio (O), enxofre (S), selênio (Se), telúrio (Te) e polônio (Po). Esses elementos estão localizados no sexto período da tabela periódica.
- Família 17 (Grupo 17): Halogênios, composta pelos elementos flúor, cloro, bromo, iodo e astato. Esses elementos possuem uma valência de 1 e são altamente reativos, especialmente com metais.
- Família 18 (Grupo 18): Gases Nobres, composta pelos elementos hélio, néon, argônio, criptônio, xenônio e radônio. Esses elementos possuem uma configuração eletrônica estável e são conhecidos por serem inertes e não reativos.
- Família dos Lantanídeos: Essa família é composta pelos 15 elementos que seguem o lantânio na tabela periódica. Esses elementos são conhecidos por suas propriedades de luminescência e são usados em dispositivos eletrônicos, como telas de televisão e monitores de computador.
- Família dos Actinídeos: Essa família é composta pelos 15 elementos que seguem o amerício na tabela periódica. Esses elementos são radioativos e muitos deles são instáveis e podem se decompor em elementos mais leves. Alguns dos elementos da família dos actinídeos são utilizados em aplicações nucleares e em reatores nucleares.
- Família dos Metais de Transição Interna: Essa família inclui os elementos colocados abaixo da tabela periódica, isolados dos outros elementos. Esses elementos têm propriedades semelhantes aos metais de transição e são conhecidos por suas propriedades magnéticas e ópticas.
A organização dos elementos em famílias permite uma melhor compreensão de suas semelhanças e propriedades, facilitando o estudo e a aplicação dos elementos químicos. Cada família possui suas próprias características e propriedades químicas específicas, o que torna a tabela periódica uma ferramenta fundamental para a compreensão e organização dos elementos químicos.

Os metais são elementos que geralmente possuem brilho, são bons condutores de eletricidade e calor, têm alta densidade e são maleáveis e dúcteis. Alguns exemplos de metais são o ferro (Fe), o cobre (Cu) e o alumínio (Al).
Os não metais são elementos que têm baixa condutividade elétrica e térmica, não possuem brilho metálico e podem ser encontrados nos três estados físicos (sólido, líquido e gasoso). Exemplos de não metais são o oxigênio (O), o enxofre (S) e o carbono (C).
Os gases nobres são elementos que fazem parte do grupo 18 da tabela periódica. Eles são quimicamente inertes, ou seja, não reagem facilmente com outros elementos, devido à sua configuração eletrônica estável. Alguns exemplos de gases nobres são o hélio (He), o néon (Ne) e o argônio (Ar).
Use as informações abaixo para responder às questões.
O que é prótio, deutério e trítio?
O que é um número atômico?
O que são íons?
Distribuição eletrônica.
Estados físicos da matéria.
Eletronegatividade.