Distribuição eletrônica em átomos neutros
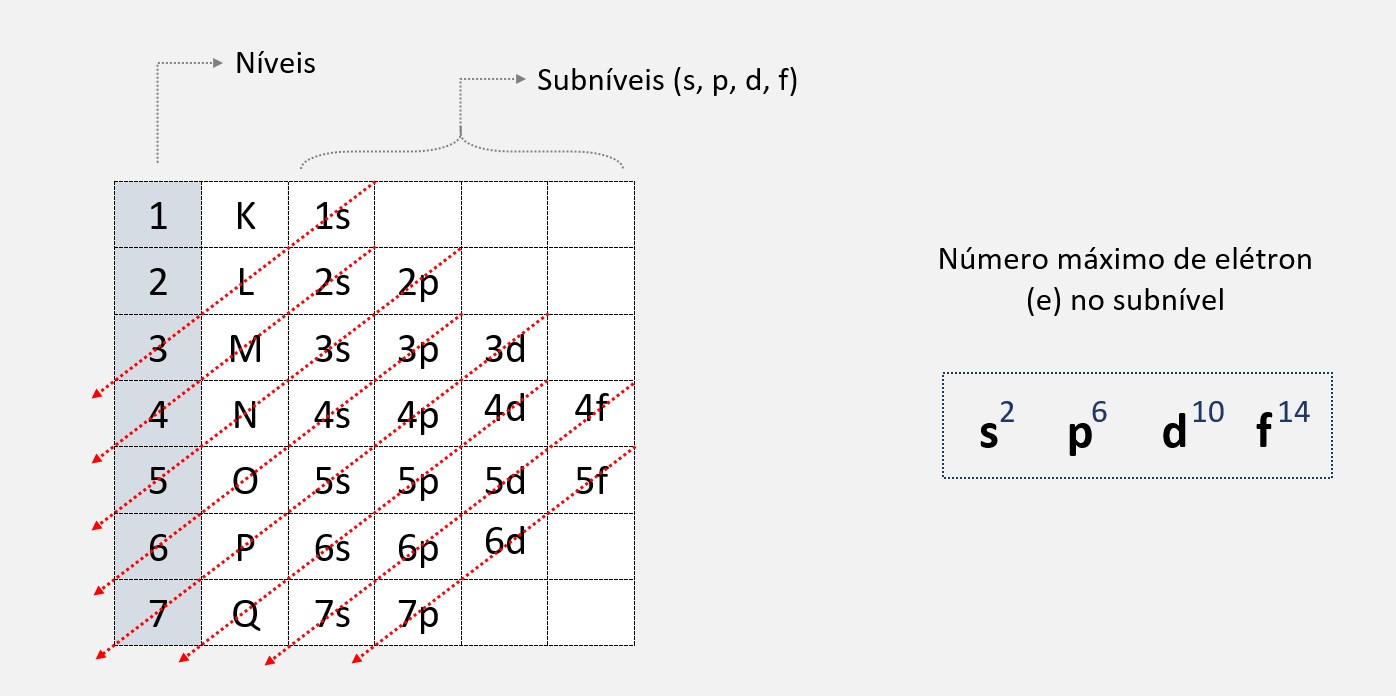
No diagrama de Pauling, cada subnível é representado por uma linha horizontal, com os elétrons representados como setas apontando para cima ou para baixo.
Na parte superior do diagrama, anotamos a quantidade de elétrons em cada subnível. Isso nos ajuda a organizar melhor a distribuição eletrônica e nos permite visualizar rapidamente a quantidade de elétrons em cada subnível.
A distribuição dos elétrons nos diferentes níveis de energia é feita de acordo com o Princípio de Aufbau, que estabelece que os elétrons devem ocupar os níveis de energia mais baixos antes de ocuparem os níveis de energia mais altos.
Por exemplo, um átomo com uma camada de valência completa tende a ser estável e não reativo, enquanto um átomo com uma camada de valência incompleta pode facilmente ganhar, perder ou compartilhar elétrons para alcançar uma configuração eletrônica mais estável. A configuração eletrônica da camada de valência também determina a posição do átomo na tabela periódica e seu grupo ou família.
Além disso, o Princípio da Exclusão de Pauli estabelece que cada elétron deve ter um número quântico de spin único, ou seja, elétrons com spins opostos devem estar em um mesmo orbital.
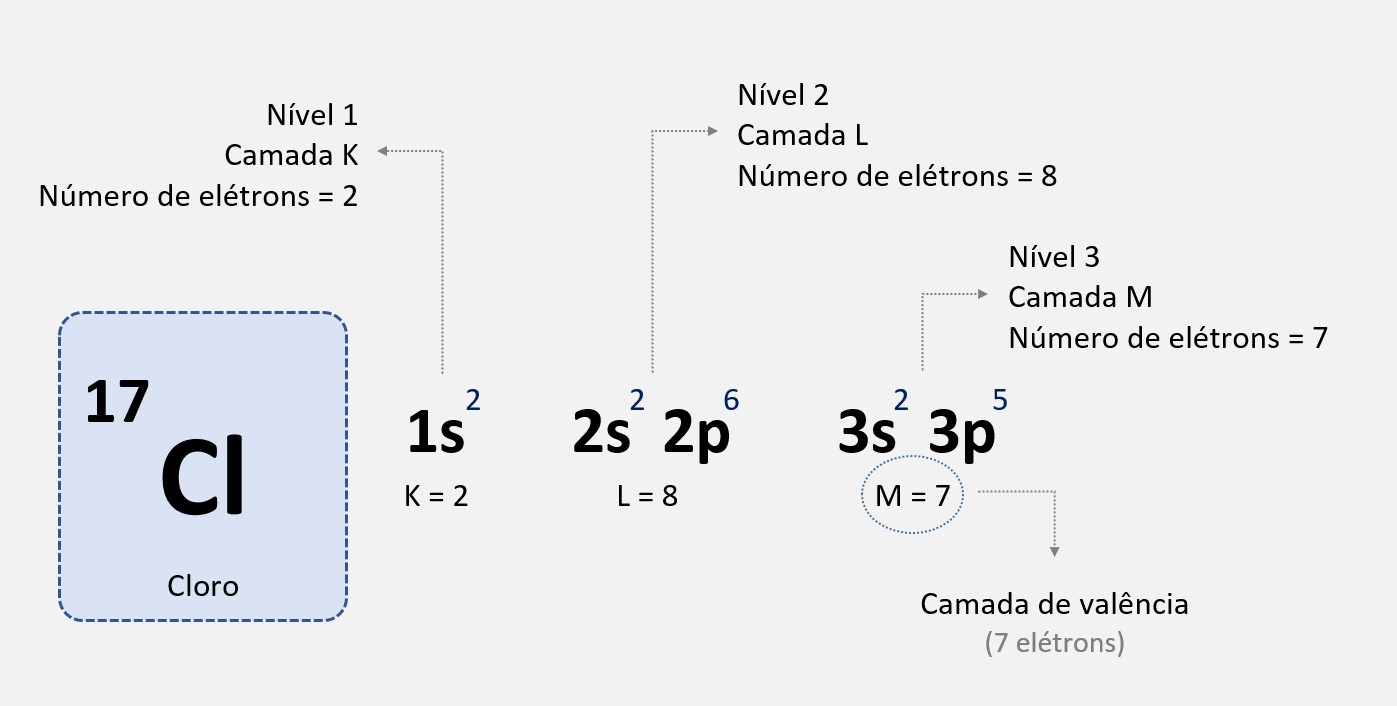
Na distribuição eletrônica, os elétrons são preenchidos em ordem de energia crescente. Cada subnível tem um nível de energia próprio, e dentro de um dado subnível, os orbitais são preenchidos em ordem crescente de energia. Por exemplo, no átomo de oxigênio (O), a configuração eletrônica é 1s2 2s2 2p4. Nesse caso, o subnível 2p é mais energético que o subnível 2s, mesmo que o subnível 2s esteja mais próximo do núcleo.
Isso ocorre devido à configuração dos orbitais no átomo. Os orbitais s são preenchidos antes dos orbitais p, mas dentro de um subnível p, os orbitais p são mais energéticos devido à sua forma e orientação espacial.
Ordem da distribuição:
A distribuição eletrônica em átomos neutros é frequentemente representada por meio de diagramas de configuração eletrônica, onde os números indicam o número de elétrons em cada nível de energia. Por exemplo, para o átomo de hélio (He) neutro, que possui 2 elétrons, a distribuição eletrônica seria representada como 1s2, onde 1s indica o nível de energia (1) e o tipo de subnível (s) e o 2 indica a quantidade de elétrons nesse subnível.
A configuração eletrônica completa de um átomo neutro é determinada pelo número atômico do elemento. A tabela periódica é organizada para mostrar a configuração eletrônica dos elementos, seguindo as regras estabelecidas pelos princípios mencionados anteriormente. Essa distribuição eletrônica é importante para entender as propriedades químicas dos elementos, como sua capacidade de formar ligações químicas ou ganhar ou perder elétrons durante reações químicas. Também é uma das informações usadas para determinar a posição de um elemento na tabela periódica.
Use as informações abaixo para responder às questões.
Distribuição eletrônica em íons