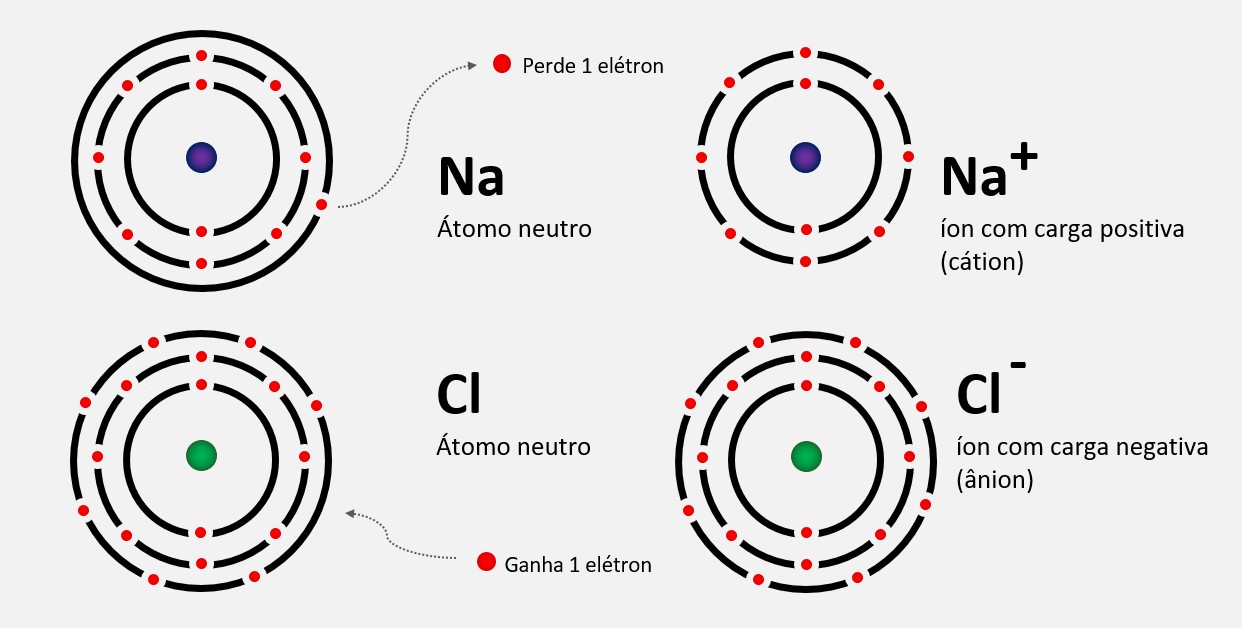
Afinidade eletrônica ou eletroafinidade
Em outras palavras, a eletroafinidade é a energia liberada ou absorvida quando um átomo ganha um elétron para formar um íon negativo. É uma medida da atração do átomo pelo elétron adicionado. Ela pode ser influenciada por diversos fatores, como a quantidade de energia necessária para adicionar o elétron, a estrutura eletrônica do átomo e a presença de outros elétrons no átomo.
A eletroafinidade é geralmente expressa em unidades de energia por mol, como joules por mol (J/mol) ou elétron-volts por mol (eV/mol). Valores positivos de eletroafinidade indicam que energia é liberada quando o elétron é adicionado, enquanto valores negativos indicam que energia é absorvida.
É importante notar que a eletroafinidade pode variar entre diferentes átomos, mesmo que sejam do mesmo elemento. Essa variação ocorre devido a diferenças na estrutura eletrônica dos átomos e à influência de outros fatores como o tamanho atômico e a carga nuclear efetiva.
Em resumo, a eletroafinidade é a energia liberada ou absorvida quando um átomo ganha um elétron para formar um íon negativo. Ela é uma medida da afinidade do átomo pelo elétron adicionado e é uma propriedade importante para determinar o comportamento químico dos elementos.
O cloro (Cl) tem uma eletroafinidade alta, de -349 kJ/mol. Isso significa que o cloro tem uma forte afinidade por elétrons e facilmente ganha um elétron para formar um íon cloreto (Cl-).
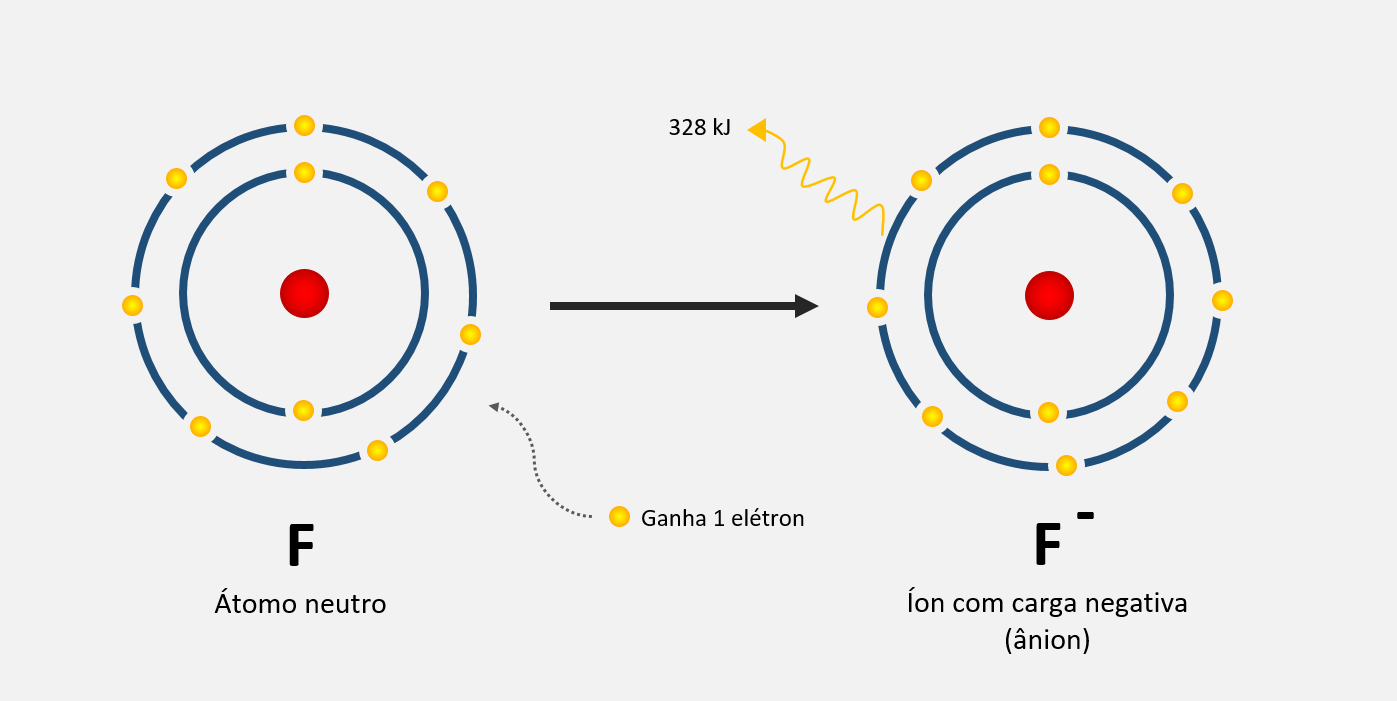
O flúor (F) também tem uma eletroafinidade alta, de -328 kJ/mol. Isso faz com que o flúor tenha uma tendência forte de ganhar elétrons e formar íons fluoreto (F-).
O oxigênio (O) possui uma eletroafinidade alta, de -141 kJ/mol. Isso indica que o oxigênio tem uma tendência de ganhar elétrons e formar íons óxido (O2-) em condições apropriadas.
O lítio (Li) e potássio (K), ambos pertencem ao grupo 1A ou 1, conhecido como grupo dos metais alcalinos. Espera-se que os elementos desse grupo tenham alta eletroafinidade, pois possuem apenas um elétron na camada de valência e têm a tendência de perder esse elétron para alcançar uma configuração eletrônica estável. No entanto, observa-se que a eletroafinidade do lítio (60 kJ/mol) é maior do que a do potássio (48 kJ/mol).
No caso do flúor (F) e do bromo (Br), ambos pertencem ao grupo 17A ou 7, conhecido como grupo dos halogênios. Espera-se que os elementos desse grupo tenham alta eletroafinidade, pois possuem um alto grau de eletronegatividade e uma grande tendência para atrair elétrons e formar íons negativos. Observa-se que a eletroafinidade do flúor (328 kJ/mol) é ligeiramente maior do que a do bromo (325 kJ/mol).