Relações diagonais
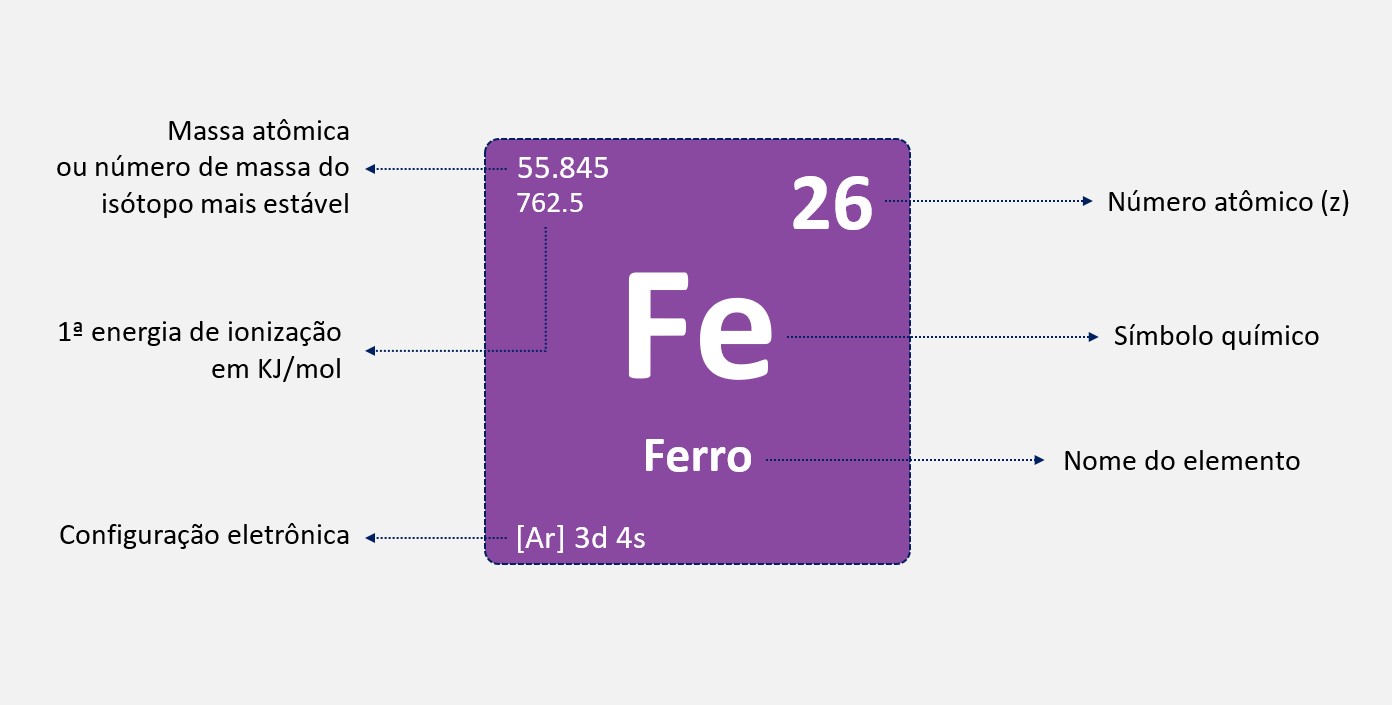
As relações diagonais na tabela periódica referem-se à existência de semelhanças entre elementos localizados em posições diagonais da tabela. Essas semelhanças ocorrem devido à similaridade da configuração eletrônica entre esses elementos. Uma relação diagonal existe quando elementos de um mesmo grupo (coluna) na tabela periódica apresentam propriedades semelhantes aos elementos localizados em um grupo adjacente, mas em uma linha diferente.
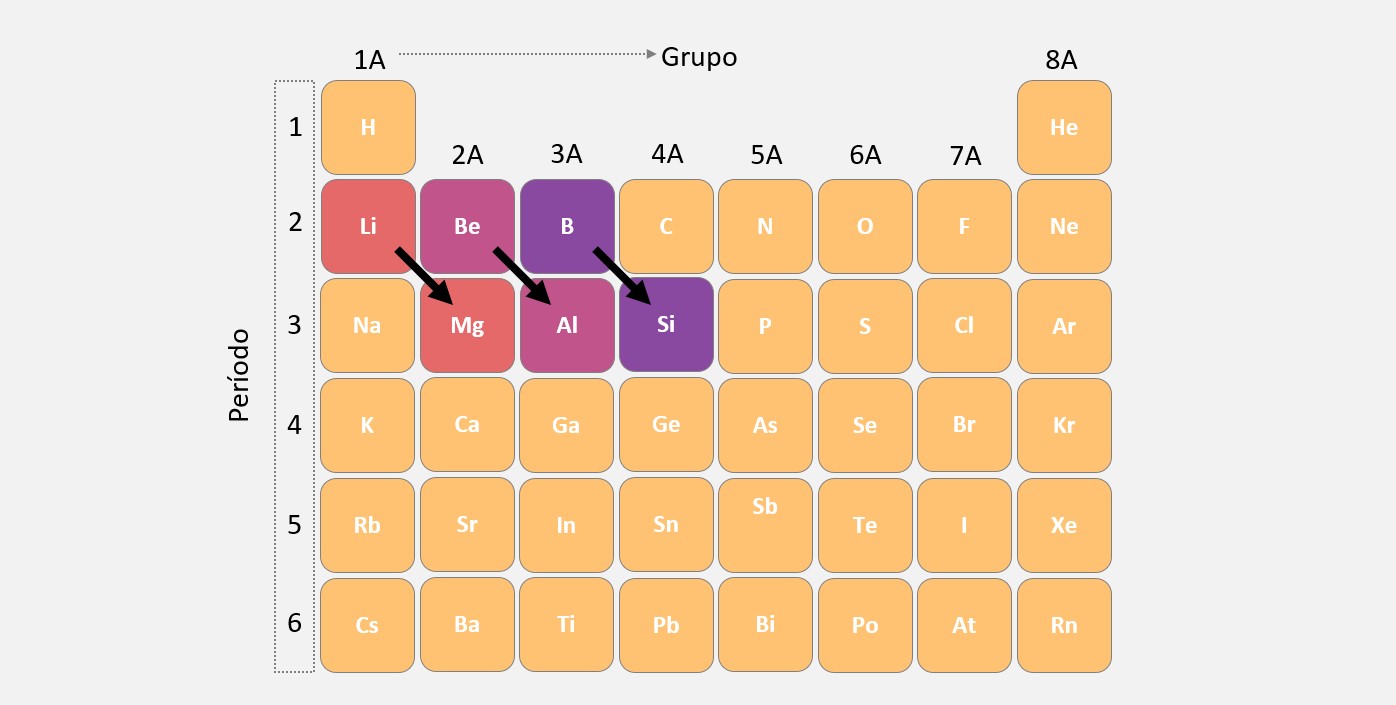
Essas relações diagonais são mais evidentes em grupos que possuem maior variação na eletronegatividade e no tamanho dos átomos ao longo do período. Esse é o caso dos grupos 1A e 2A, além dos grupos 3A e 4A.
As relações diagonais são mais comuns entre os elementos dos blocos s e p da tabela periódica, onde existem grupos de elementos com propriedades químicas semelhantes, mas localizados em períodos diferentes.
Por exemplo, o lítio (Li) e o magnésio (Mg) apresentam relações diagonais, pois ambos são metais alcalinos-terrosos e possuem propriedades químicas semelhantes, apesar de estarem em grupos diferentes.
Essas relações diagonais são úteis para prever propriedades e comportamentos de elementos com base em outras informações disponíveis na tabela periódica.