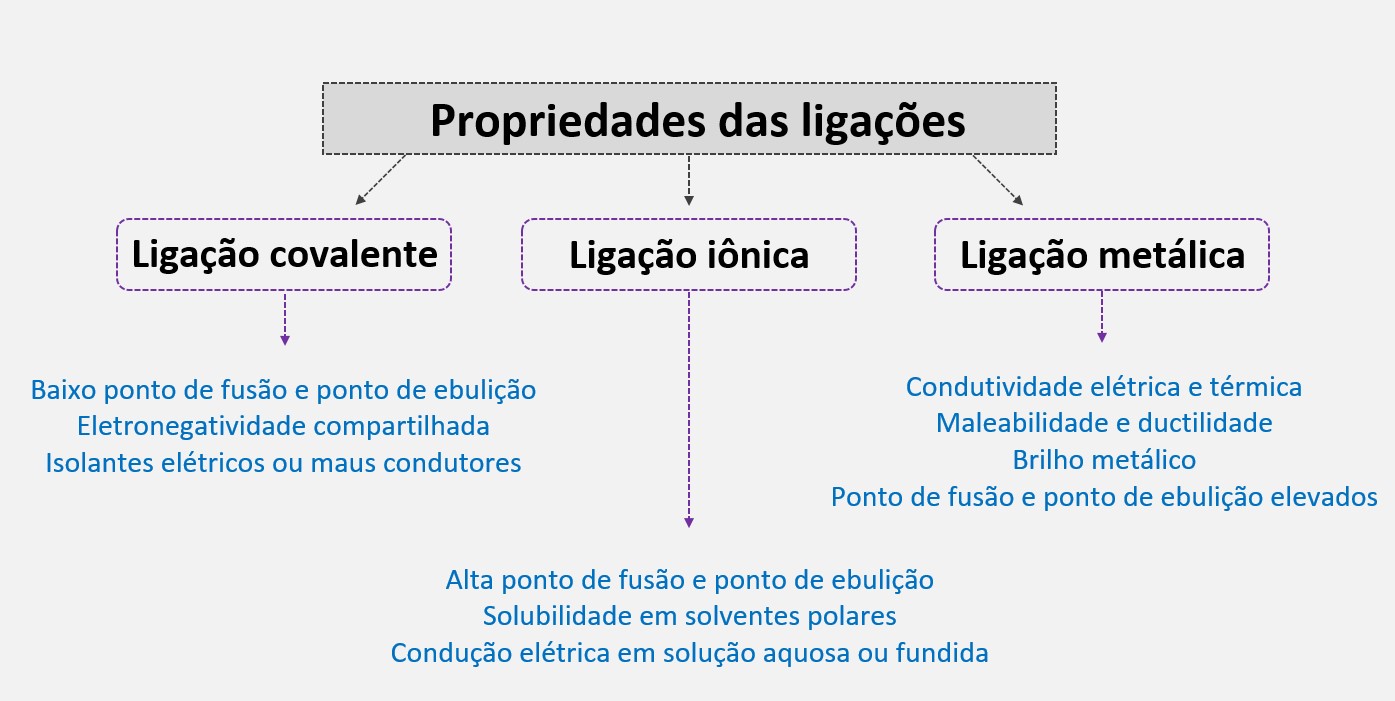
Propriedades das ligações metálicas, iônicas e covalentes
As ligações metálicas, iônicas e covalentes são tipos de ligações químicas que ocorrem entre átomos. Cada uma dessas ligações tem características e propriedades específicas.
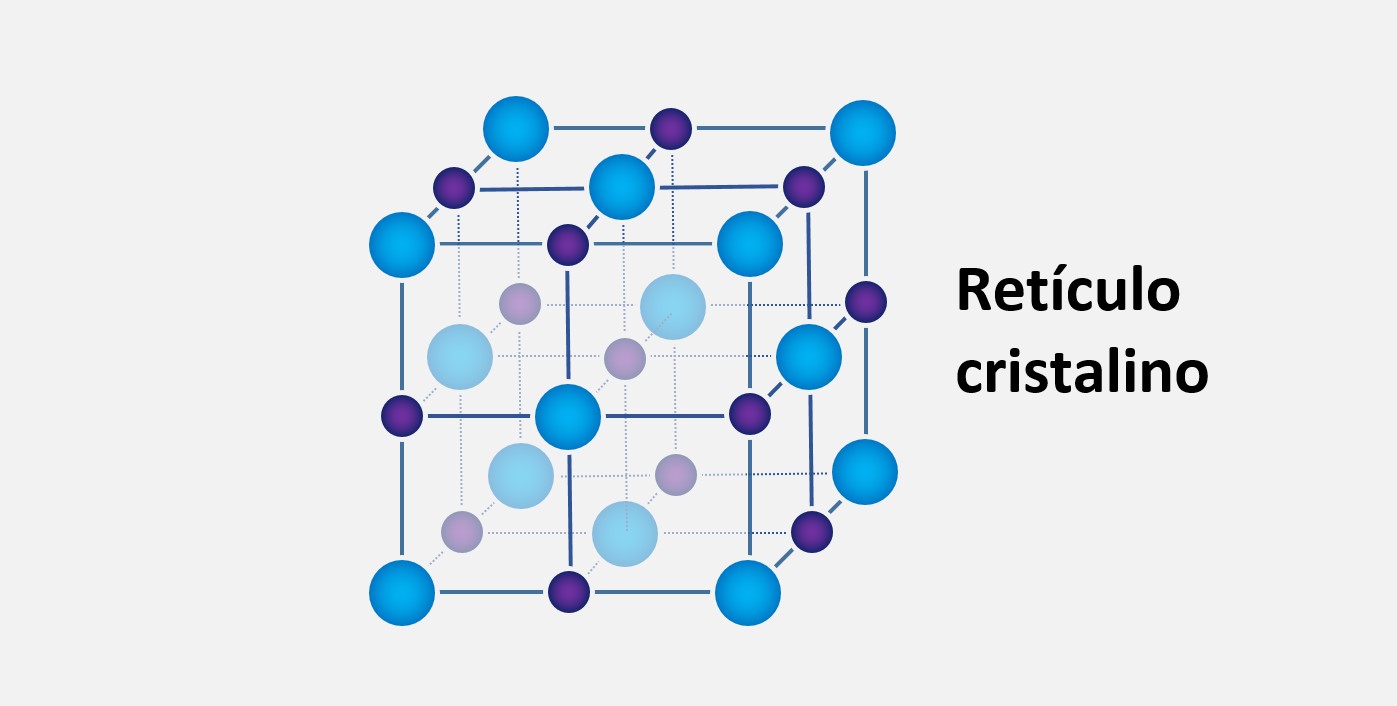
1. Ligação metálica: A ligação metálica ocorre entre átomos de metais e é caracterizada pela formação de uma rede tridimensional de átomos com elétrons de valência "compartilhados" entre eles. Algumas propriedades das ligações metálicas incluem:
- Condutividade elétrica e térmica: Os metais são excelentes condutores de eletricidade e calor devido à mobilidade dos elétrons na rede metálica.
- Maleabilidade e ductilidade: Os metais são maleáveis e podem ser facilmente moldados em diferentes formas e esticados em fios.
- Brilho metálico: A ligação metálica possibilita a formação de uma estrutura cristalina regular, que reflete a luz de maneira característica.
- Ponto de fusão e ponto de ebulição elevados: As ligações metálicas são fortes e requerem uma quantidade significativa de energia para quebrar as ligações metálicas e transformar o metal de sólido para líquido ou gasoso.
2. Ligação iônica: A ligação iônica ocorre entre átomos de elementos diferentes, geralmente um metal e um não metal, onde os elétrons são transferidos de um átomo para outro para formar cátions (íons com carga positiva) e ânions (íons com carga negativa). Algumas propriedades das ligações iônicas incluem:
- Alta ponto de fusão e ponto de ebulição: As ligações iônicas são fortes e requerem muita energia para quebrar as ligações e mudar de estado físico.
- Solubilidade em solventes polares: Os compostos iônicos geralmente são solúveis em solventes polares, como água, porque as moléculas polares são capazes de interagir com os íons positivos e negativos.
- Condução elétrica em solução aquosa ou fundida: Os compostos iônicos só conduzem eletricidade quando estão em solução aquosa ou no estado fundido, pois é necessário que os íons estejam livres para se moverem e conduzir a corrente elétrica.
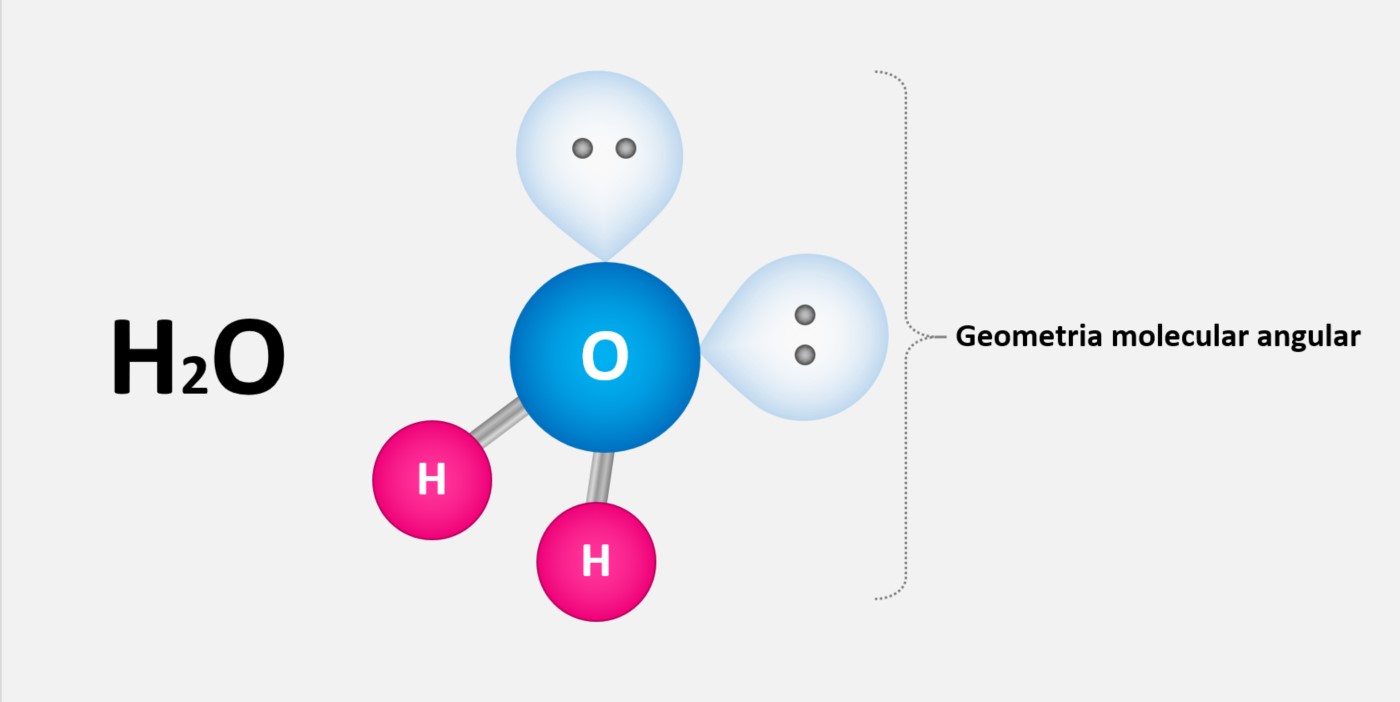
3. Ligação covalente: A ligação covalente ocorre quando os átomos compartilham elétrons de valência. Ela pode ocorrer entre átomos do mesmo elemento (ligação covalente homopolar) ou entre átomos de diferentes elementos (ligação covalente heteropolar). Algumas propriedades das ligações covalentes incluem:
- Baixo ponto de fusão e ponto de ebulição: As ligações covalentes são relativamente fracas e, geralmente, requerem menos energia para quebrar as ligações e mudar de estado físico em comparação com as ligações iônicas ou metálicas.
- Eletronegatividade compartilhada: Os elétrons de valência são compartilhados entre os átomos, resultando em uma distribuição mais uniforme de carga eletrônica.
- Isolantes elétricos ou maus condutores: Os compostos covalentes são geralmente maus condutores de eletricidade, pois os elétrons de valência estão envolvidos em ligações compartilhadas e não estão livres para se moverem.
Lembrando que essas são apenas algumas das propriedades gerais das ligações metálicas, iônicas e covalentes. Cada tipo de ligação tem suas próprias características e propriedades específicas, e existem muitas variações dentro de cada categoria.