O que são forças intermoleculares?
Forças intermoleculares são forças atrativas que existem entre as moléculas. Essas forças são responsáveis pela coesão entre as moléculas e são essenciais para determinar as propriedades físicas das substâncias, como ponto de fusão, ponto de ebulição e solubilidade.
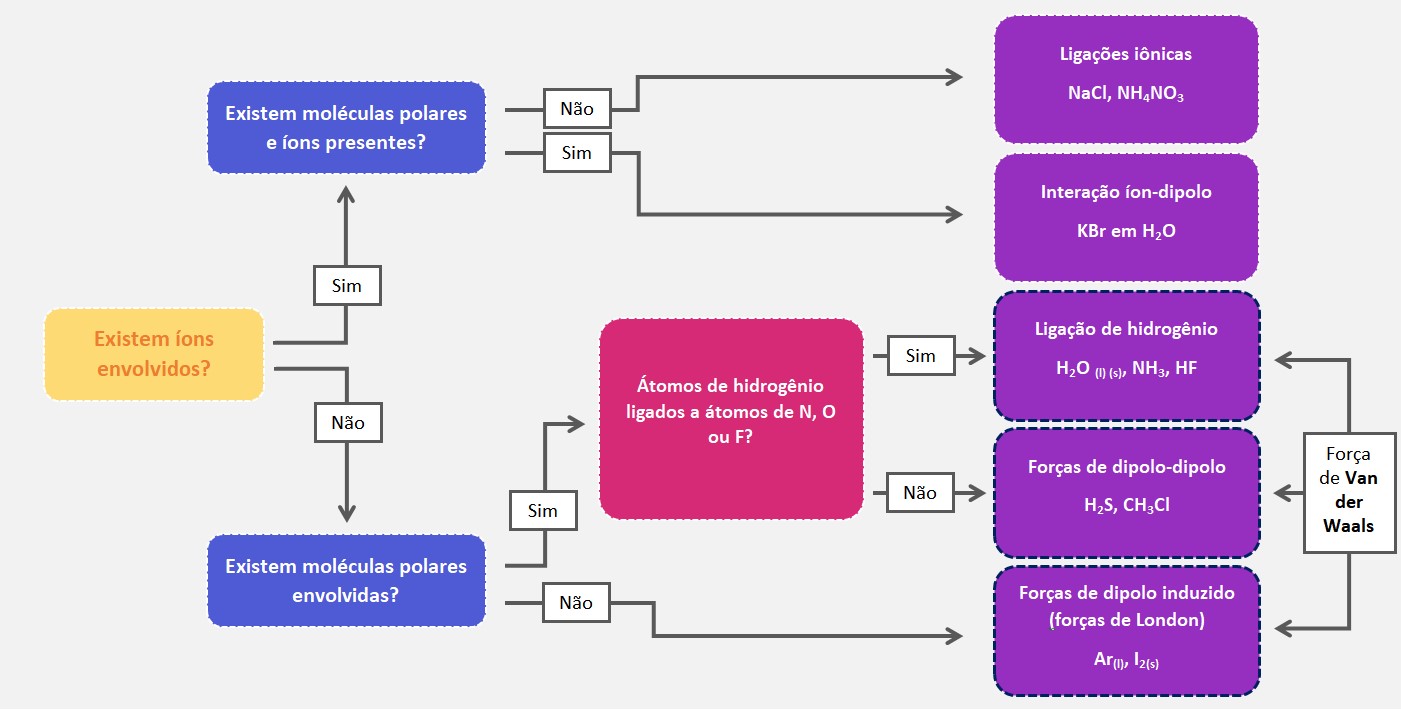
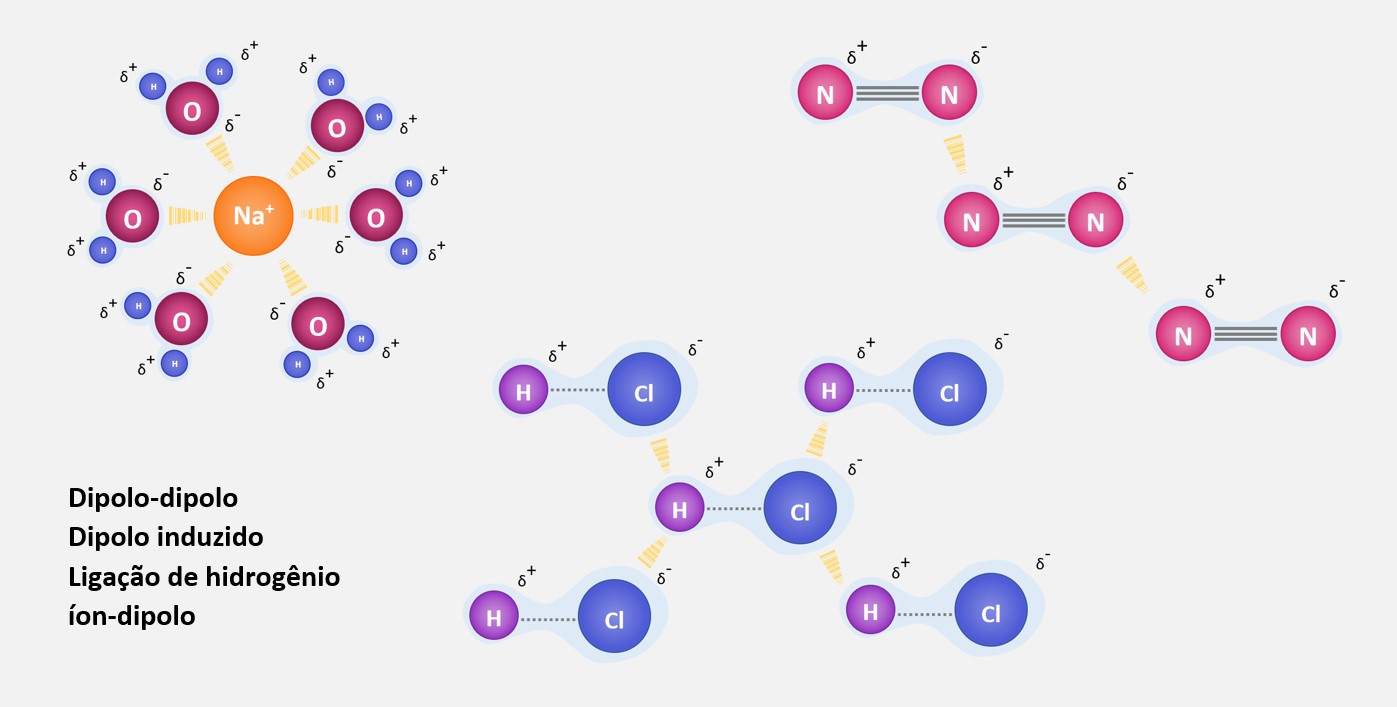
Existem três principais tipos de forças intermoleculares: forças de dipolo-dipolo, forças de dipolo induzido (ou forças de London) e pontes de hidrogênio. Essas forças variam em intensidade, sendo que as pontes de hidrogênio são as mais fortes e as forças de London são as mais fracas.
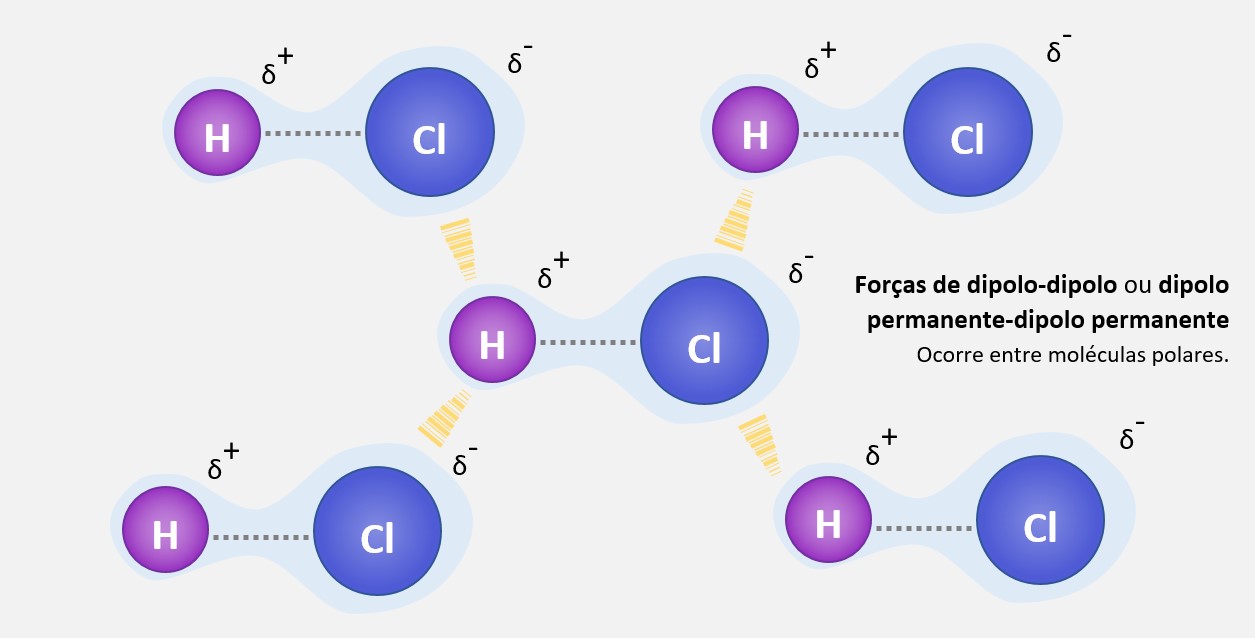
Essas forças surgem devido à atração eletrostática entre as regiões positivas de uma molécula polar e as regiões negativas de outra molécula polar. Isso ocorre porque as moléculas polares têm momentos dipolares, ou seja, possuem um polo positivo e um polo negativo.
As forças de dipolo-dipolo são mais fortes do que as forças de dispersão de London, mas mais fracas do que as forças de ligação de hidrogênio. As moléculas polares interagem por meio dessas forças, resultando em uma atração mais forte entre elas e, consequentemente, em um maior ponto de ebulição e maior energia de vaporização em comparação com moléculas apolares. Essas forças também podem influenciar propriedades como solubilidade e tensão superficial.
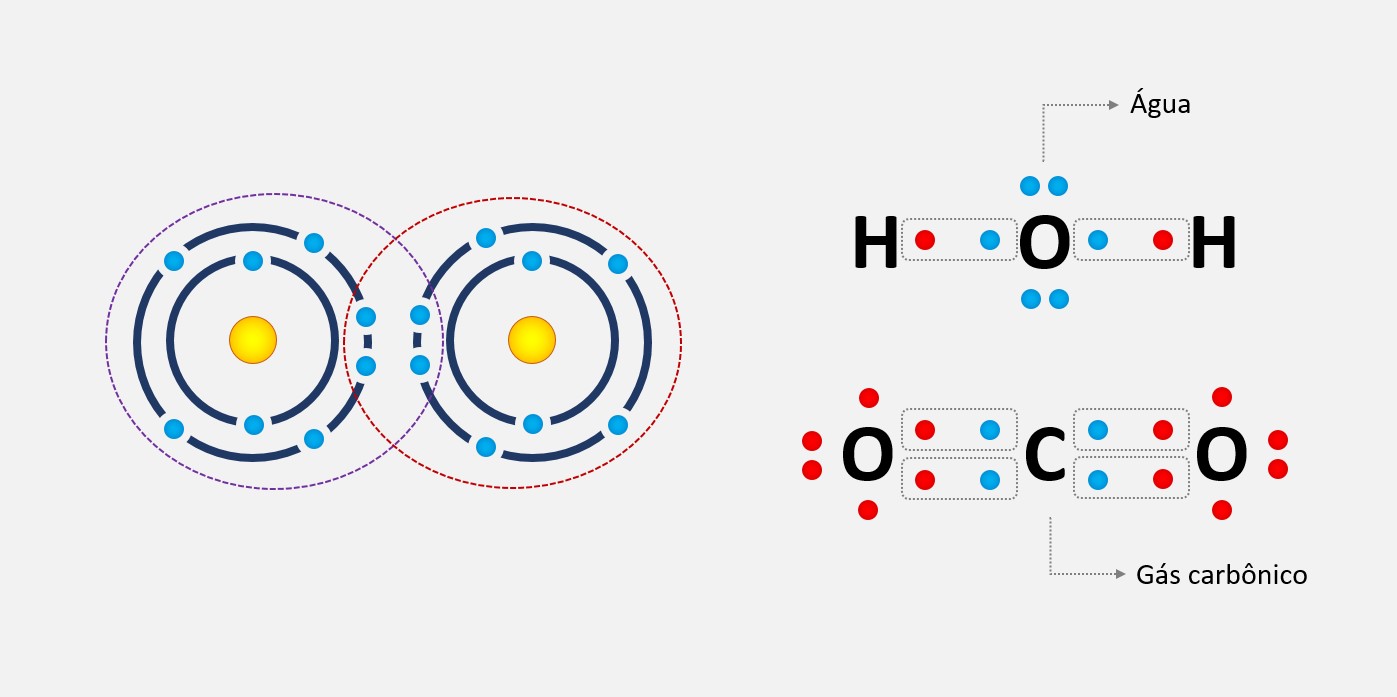
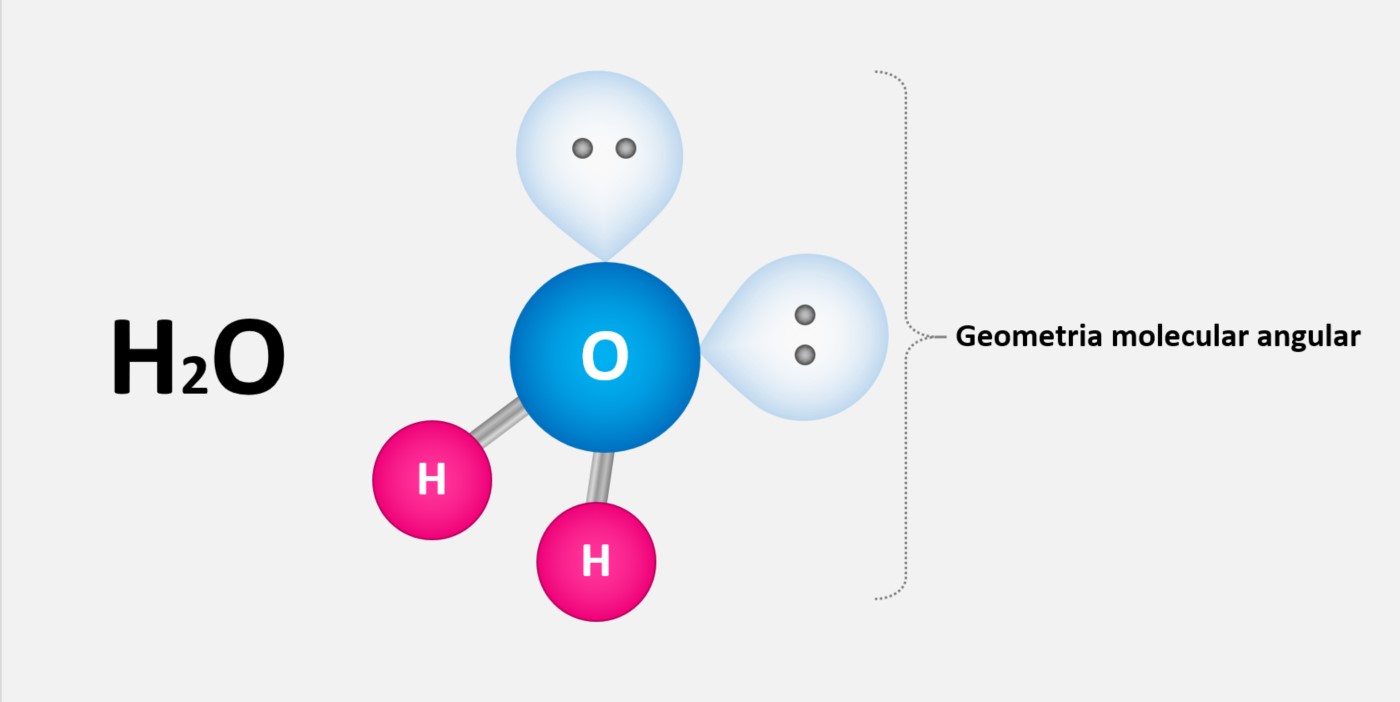
Um exemplo comum de forças de dipolo-dipolo ocorre na molécula de água (H2O). Nessa molécula, o oxigênio é mais eletronegativo do que o hidrogênio, o que significa que ele atrai mais fortemente os elétrons que são compartilhados entre eles. Isso resulta em uma distribuição de carga desigual e em um momento dipolar, com o oxigênio sendo parcialmente negativo e os hidrogênios parcialmente positivos.
Quando as moléculas de água se aproximam umas das outras, ocorre uma atração entre as cargas opostas. Essa atração é a força de dipolo-dipolo. Essa força é responsável por propriedades como a alta solubilidade da água em substâncias polares e a capacidade da água de formar ligações de hidrogênio com outras moléculas polares.
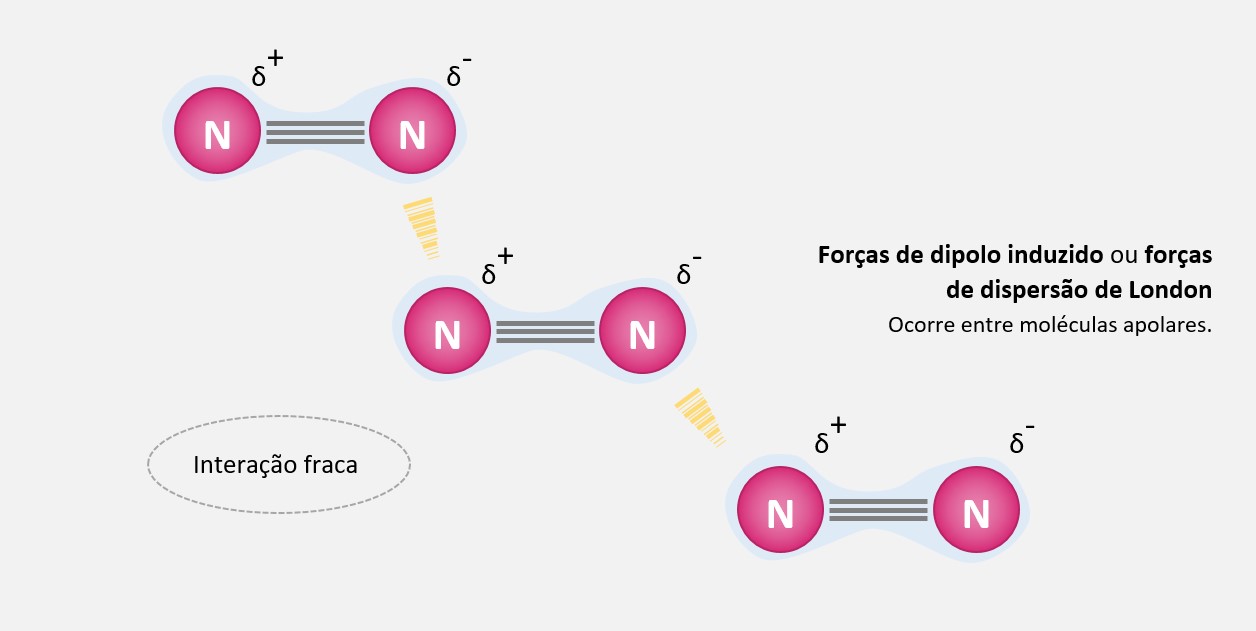
Devido à natureza probabilística do movimento dos elétrons, em um dado momento, uma molécula apolar pode ter uma distribuição das cargas eletrônicas momentaneamente desigual, formando um dipolo instantâneo. Esse dipolo induz um dipolo instantâneo em uma molécula vizinha, resultando em uma atração entre as duas moléculas.
Essas flutuações momentâneas nos dipolos induzidos ocorrem em todas as moléculas e são responsáveis pela formação das forças de dispersão de London. Quanto maior a massa molar da molécula, maior será a chance de ter flutuações momentâneas mais intensas, o que resulta em forças de dipolo induzido mais fortes.
As forças de dipolo induzido são importantes em diversas propriedades físicas e químicas, como ponto de ebulição, polarizabilidade, viscosidade e solubilidade. Quanto mais fortes forem essas forças entre as moléculas, maior será sua tendência em se agrupar e formar um estado líquido ou sólido.
É importante ressaltar que as forças de dipolo induzido estão presentes em todas as moléculas, polares ou apolares, mas são mais significativas em moléculas apolares, uma vez que não há a presença de forças de dipolo-dipolo em moléculas apolares. Portanto, as forças de dispersão de London são as principais forças que atuam entre moléculas apolares.
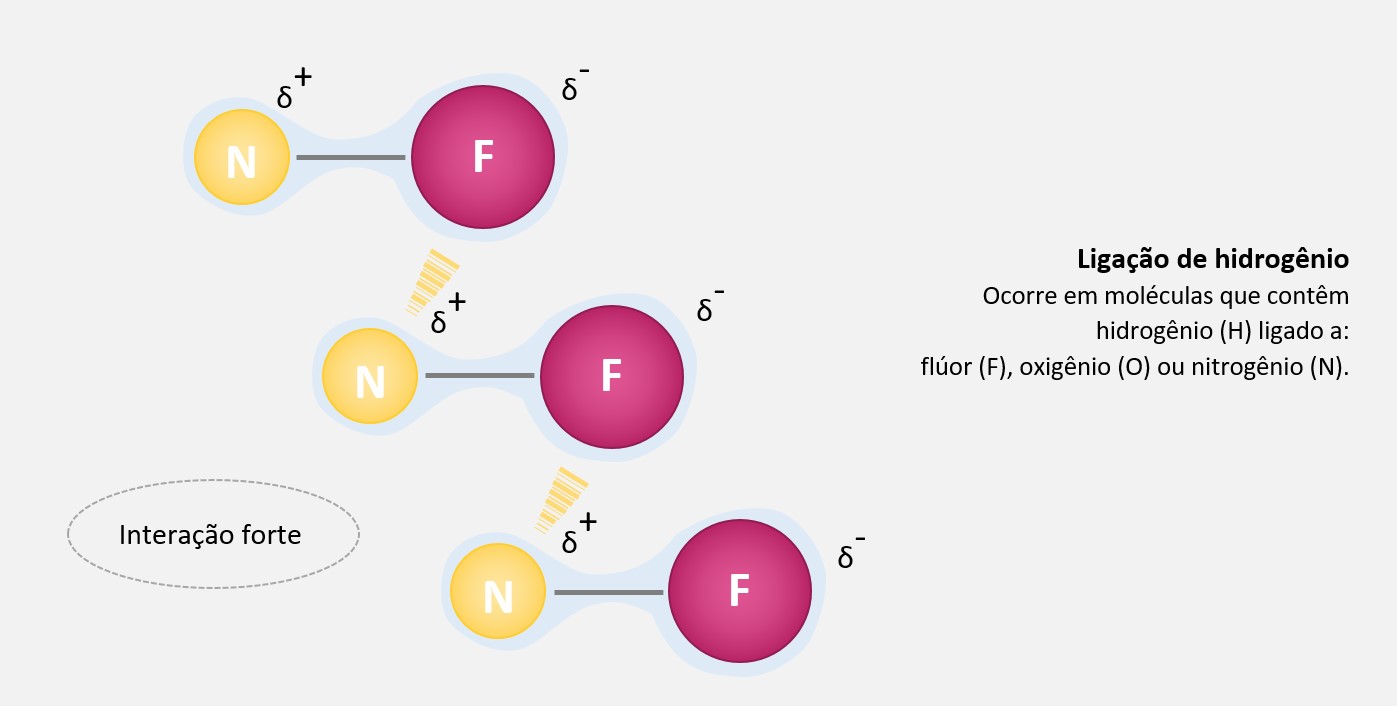
Essas ligações de hidrogênio são consideradas forças intermoleculares fortes e têm uma importância significativa em várias propriedades e reações químicas.
As pontes de hidrogênio são responsáveis, por exemplo, pela alta tensão superficial e elevado ponto de ebulição da água, bem como pela formação de estruturas complexas em biomoléculas, como o DNA e as proteínas.
Essas forças também desempenham um papel importante na solubilidade de compostos polares em solventes polares, como a dissolução de açúcares em água. As pontes de hidrogênio podem criar uma ligação entre o hidrogênio de uma molécula de açúcar e os átomos de oxigênio da molécula de água, facilitando a dissolução.
É importante ressaltar que as pontes de hidrogênio não envolvem a transferência de elétrons entre as moléculas, como em uma ligação iônica ou covalente. Em vez disso, elas são baseadas na atração eletrostática entre o átomo de hidrogênio parcialmente positivo e o átomo eletronegativo parcialmente negativo, formando uma ligação fraca, porém significativa.
Em resumo, as pontes de hidrogênio são forças intermoleculares que ocorrem quando um átomo de hidrogênio ligado a átomos eletronegativos forma uma ligação fraca com um átomo eletronegativo em outra molécula. Essas forças desempenham um papel importante na determinação de várias propriedades físicas e químicas das substâncias, bem como na estabilidade e estrutura de muitos compostos.
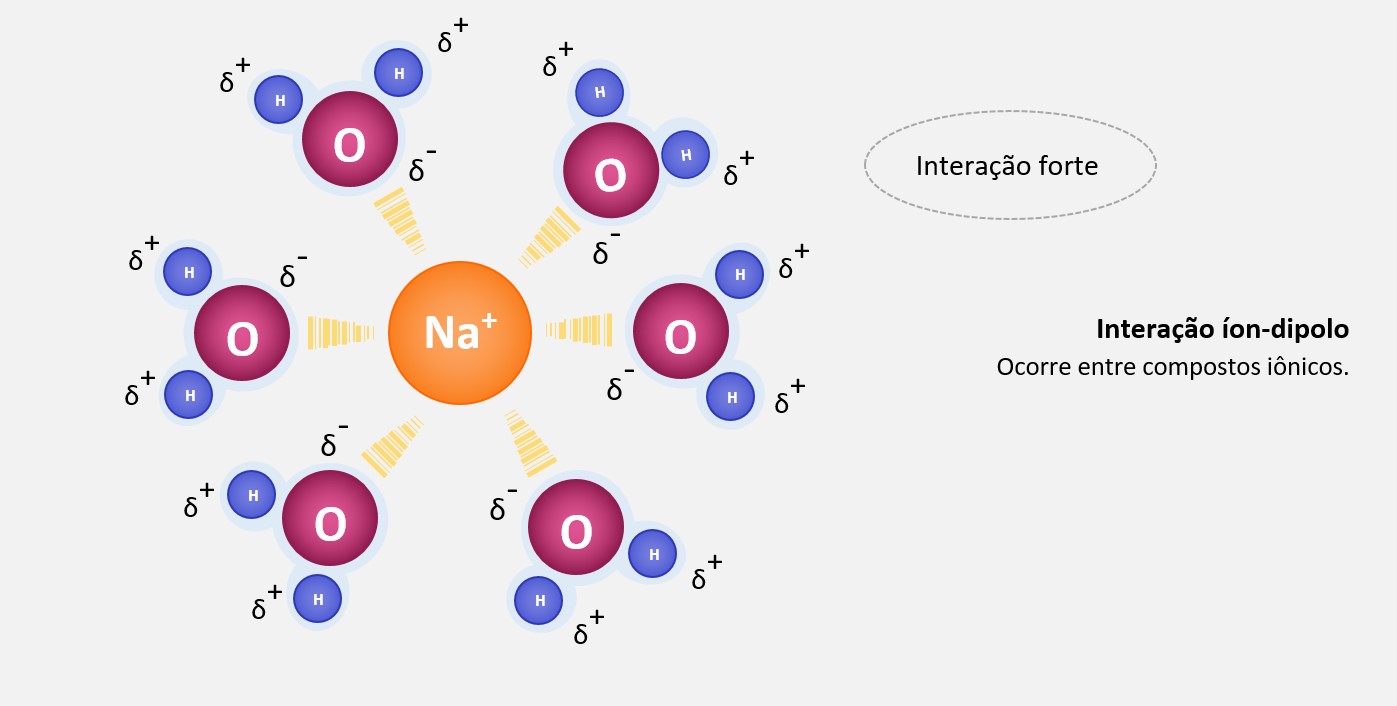
Quando um íon é formado, ele perde ou ganha elétrons, resultando em uma carga positiva ou negativa. Por outro lado, uma molécula polar tem uma distribuição assimétrica de cargas elétricas, com uma região mais eletronegativa e uma região mais eletronegativa.
Essa diferença de cargas permite que o íon e a molécula polar se atraiam. A carga do íon oposta à carga parcial oposta da molécula resulta em uma atração eletrostática, formando a interação íon-dipolo. Essa interação é mais forte do que as forças de dipolo-dipolo.
A interação íon-dipolo é fundamental em muitos processos químicos e físicos. Por exemplo, quando um sal, como o cloreto de sódio (NaCl), é dissolvido em água, ocorre a interação íon-dipolo entre os íons de Na+ e Cl- e as moléculas de água. Isso permite a dissociação dos íons no solvente, tornando a solução condutora de eletricidade.
Além disso, a interação íon-dipolo também desempenha um papel importante na solubilidade de substâncias iônicas em solventes polares, como água. A atração entre os íons e as moléculas polares facilita a dissolução das substâncias iônicas.
É importante ressaltar que a interação íon-dipolo ocorre apenas entre íons carregados e moléculas polares. Em moléculas apolares, não há carga parcial oposta para estabelecer essa interação.