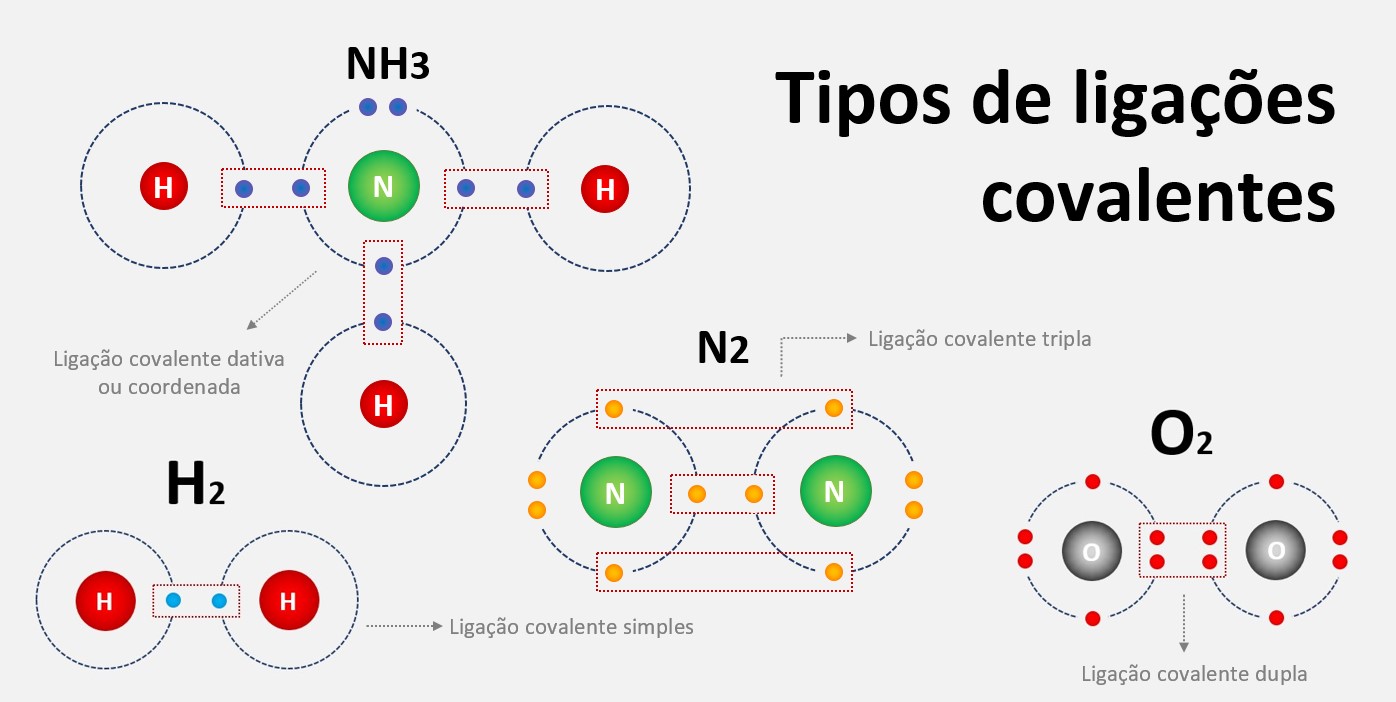
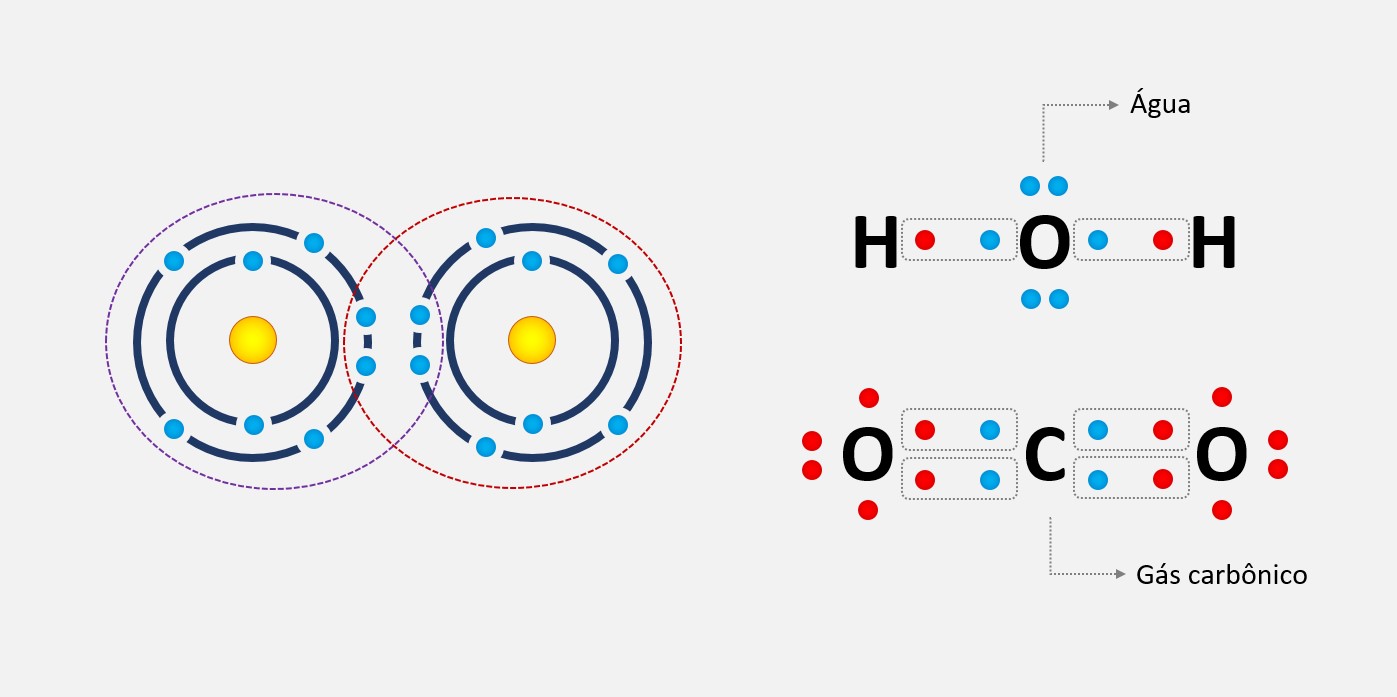
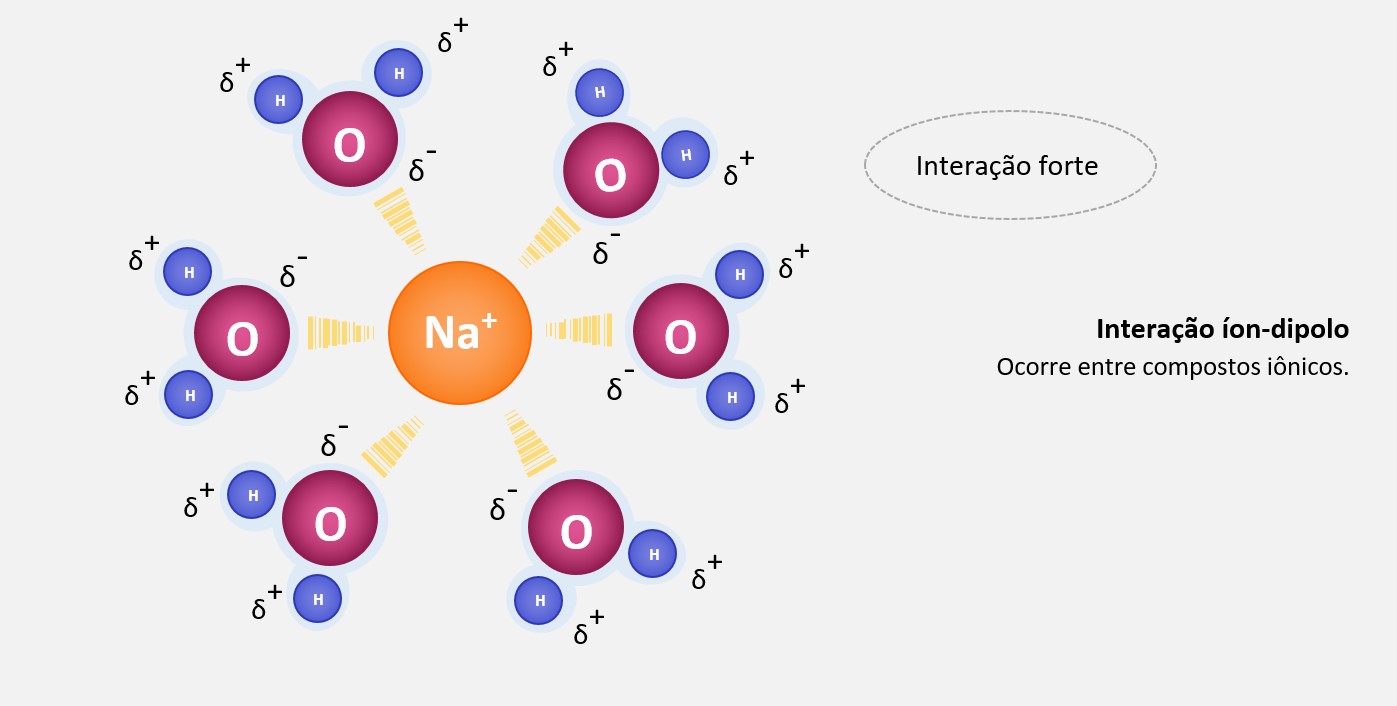
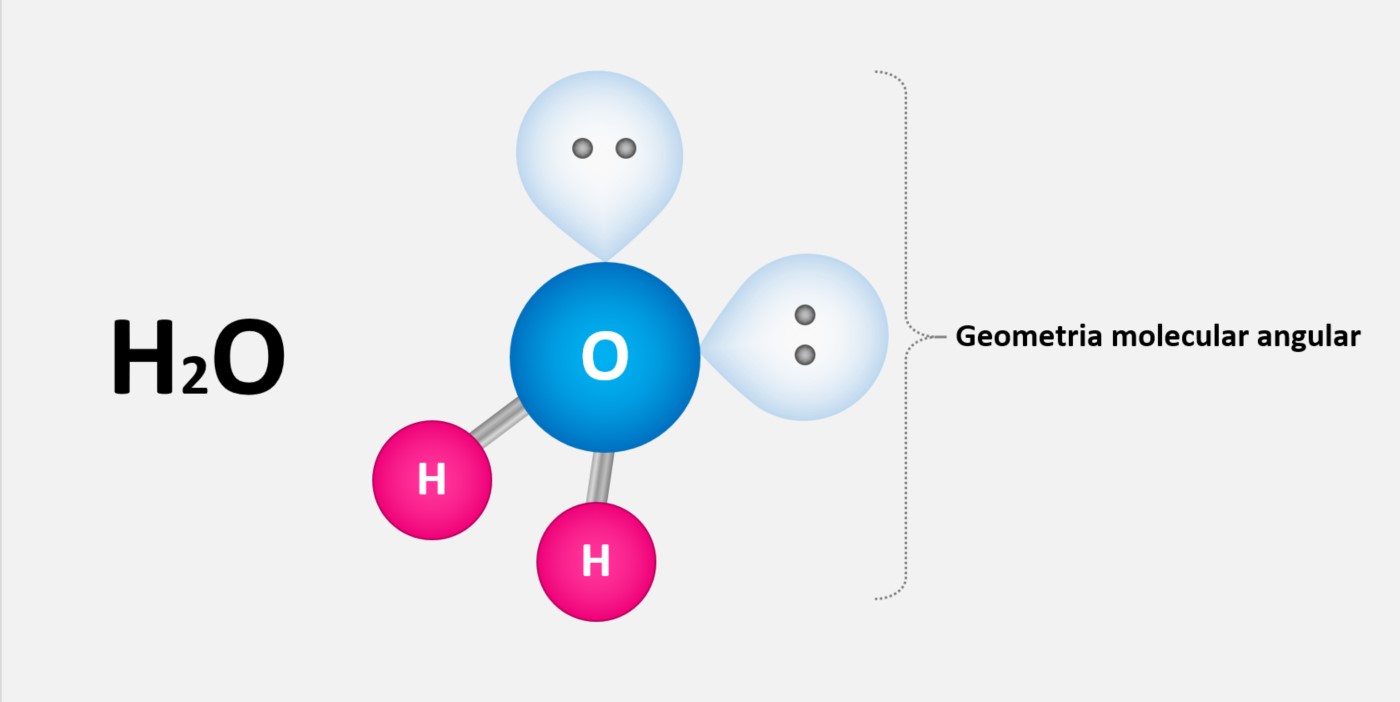
Ligação metálica

Ligação metálica é uma forma de ligação química que ocorre entre átomos de metais. Nessa ligação, os elétrons de valência dos átomos metálicos se deslocam livremente através de toda a estrutura cristalina, formando uma nuvem eletrônica comum a todos os átomos do metal. Essa nuvem eletrônica é responsável por algumas das propriedades características dos metais, como a condutividade elétrica e térmica, a maleabilidade e a ductilidade.
A ligação metálica forma-se devido a um fenômeno conhecido como "delocalização eletrônica", que ocorre nos metais devido à sua estrutura de rede cristalina. Nessa estrutura, os átomos metálicos estão organizados em um padrão regular, com os elétrons de valência compartilhados entre os átomos adjacentes.
Os elétrons de valência dos átomos metálicos têm a capacidade de se mover livremente dentro da estrutura cristalina. Isso ocorre porque os átomos metálicos têm baixa afinidade eletrônica e alta energia de ionização, o que significa que eles tendem a perder elétrons com facilidade. Esses elétrons "livres" ficam deslocalizados e podem se mover em todo o metal.
A presença dessa nuvem eletrônica comum proporciona algumas propriedades características dos metais.
Além disso, a ligação metálica também é responsável pela maleabilidade e ductilidade dos metais. Aos materiais com ligação metálica é possível deformá-los sem quebrá-los, permitindo que sejam moldados em diferentes formas por meio de forças externas, como a martelagem ou o estiramento.
Em resumo, a ligação metálica é um tipo de ligação química na qual os elétrons de valência dos átomos metálicos são compartilhados e delocalizados, formando uma nuvem eletrônica comum. Isso resulta em propriedades caracteristicamente metálicas, como a condutividade elétrica e térmica, a maleabilidade e a ductilidade.
Aqui estão alguns exemplos de metais encontrados na tabela periódica:
- Lítio (Li)
- Sódio (Na)
- Potássio (K)
- Cálcio (Ca)
- Magnésio (Mg)
- Berílio (Be)
- Alumínio (Al)
- Ferro (Fe)
- Cobre (Cu)
- Zinco (Zn)
- Prata (Ag)
- Ouro (Au)
- Chumbo (Pb)
- Níquel (Ni)
- Platina (Pt)
- Mercúrio (Hg)
Esses são apenas alguns exemplos de metais que estão presentes na tabela periódica. Existem muitos outros metais, cada um com suas próprias propriedades e aplicações.