Prótio, deutério, trítio: os isótopos do hidrogênio
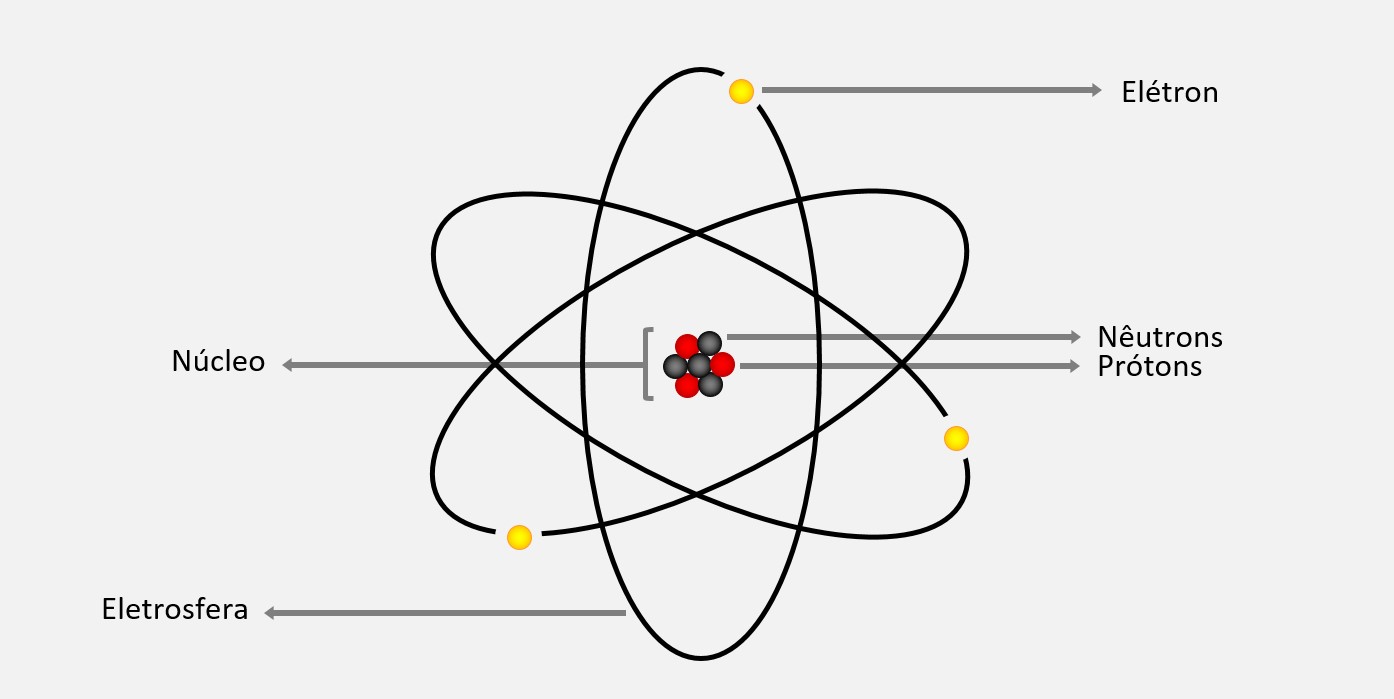
Isótopos são átomos do mesmo elemento químico, o que significa que eles têm o mesmo número atômico, representado pela letra Z, que corresponde ao número de prótons no núcleo do átomo. No entanto, eles têm diferentes números de massa, representado pela letra A, que corresponde à soma do número de prótons e nêutrons no núcleo do átomo.
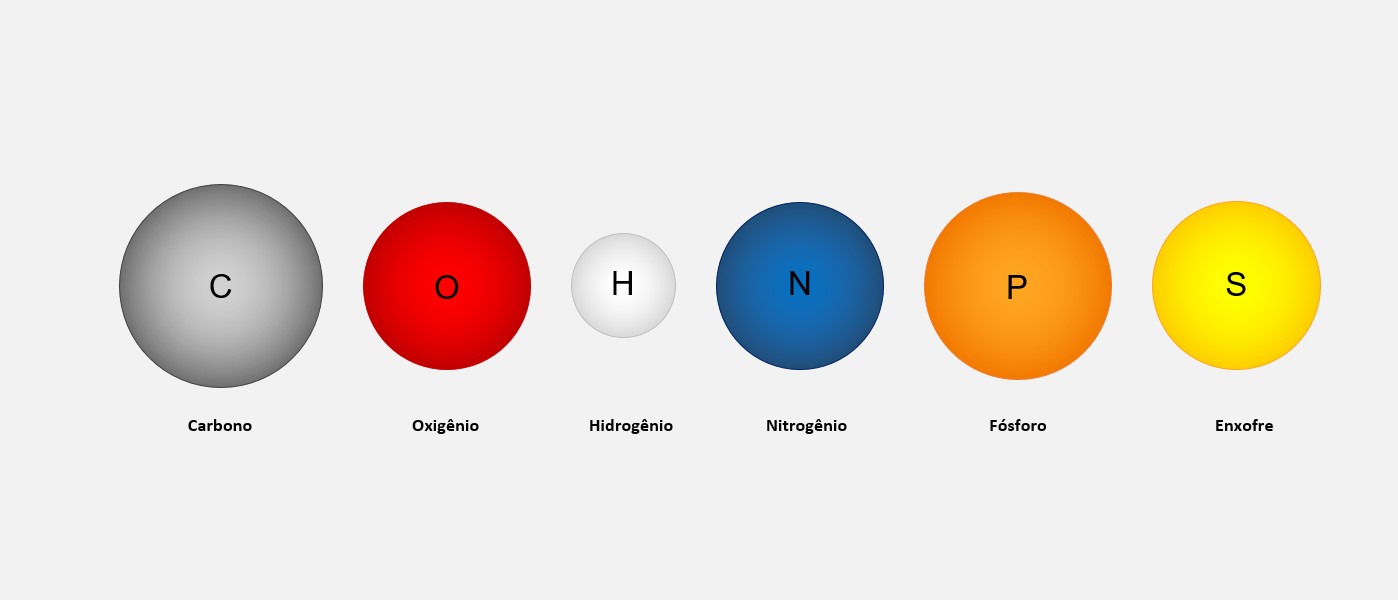
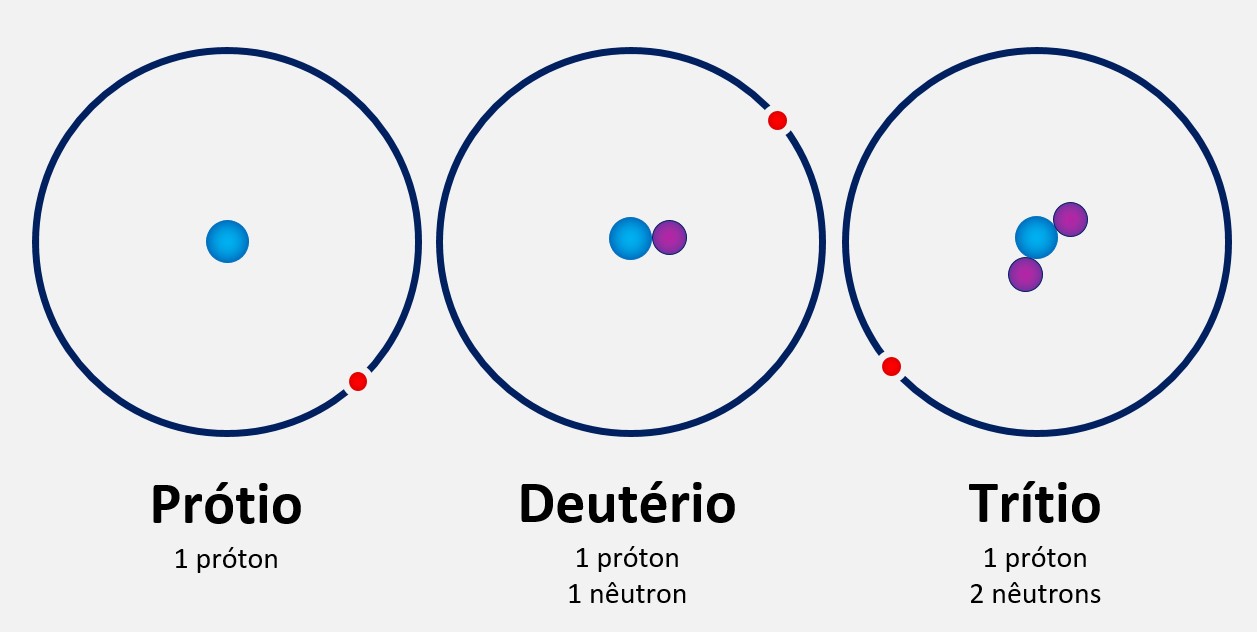
Um exemplo comum é o hidrogênio, que tem três isótopos principais.
O prótio é o isótopo mais comum do hidrogênio, composto por apenas um próton e nenhum nêutron em seu núcleo. Ele não possui massa nuclear significativa.
O deutério é um isótopo do hidrogênio que contém um próton e um nêutron em seu núcleo. É cerca de duas vezes mais pesado que o prótio.
O trítio é um isótopo do hidrogênio que contém um próton e dois nêutrons em seu núcleo. Ele é cerca de três vezes mais pesado que o prótio. Esses isótopos do hidrogênio têm diferentes aplicações.
O deutério é usado em uma variedade de aplicações, incluindo análises químicas, pesquisa nuclear e produção de água pesada.
O trítio é usado principalmente em armas nucleares e, em menor escala, em dispositivos de iluminação, como relógios autoluminosos e lanternas de emergência. No entanto, devido à sua radioatividade, o trítio é altamente controlado e seu uso é estritamente regulamentado.