Modelo atômico de Rutherford
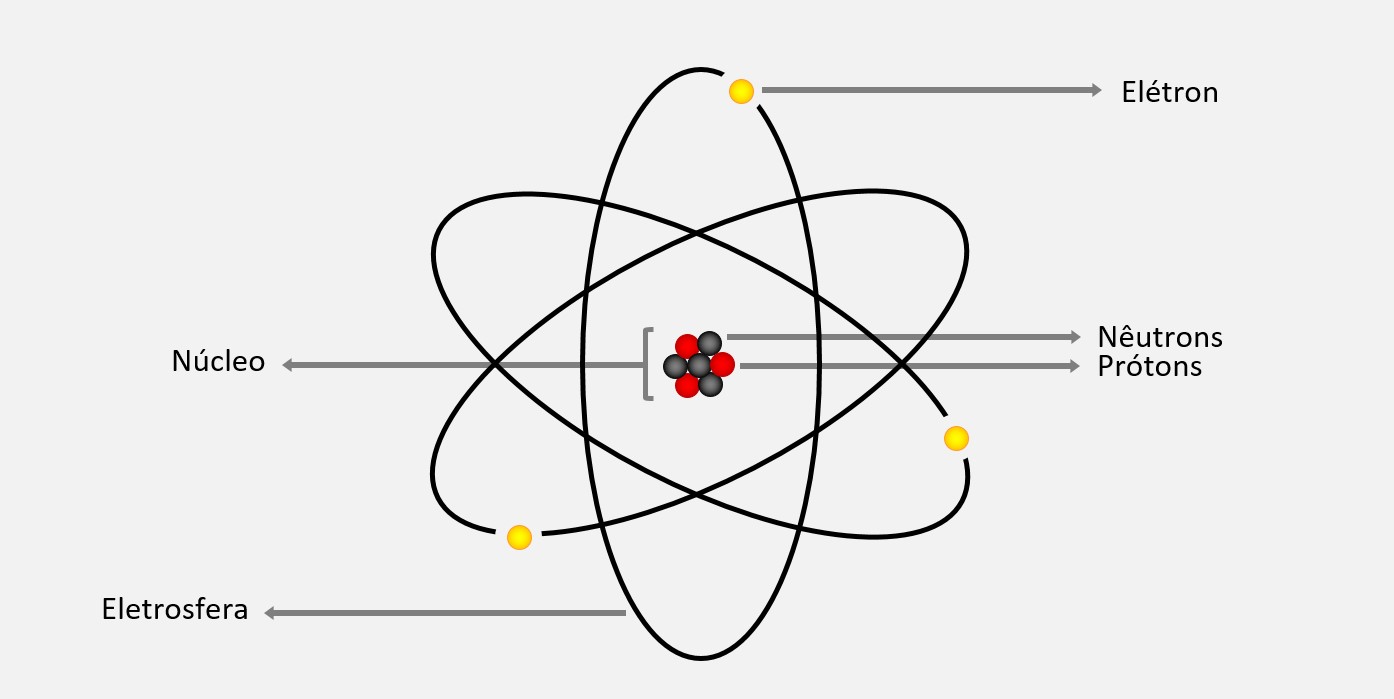
O modelo atômico proposto por Rutherford em 1911 é conhecido como o modelo planetário ou modelo do sistema solar. Ele postulava que os elétrons orbitavam ao redor do núcleo, assim como os planetas orbitam ao redor do sol. O núcleo, que é positivamente carregado, representa o sol, enquanto os elétrons, que são negativamente carregados, representam os planetas.
Essa conclusão é baseada no fato de que durante o experimento, a maioria das partículas a atravessava a lâmina de ouro praticamente sem sofrer desvios, o que indica que a maior parte do átomo é formada por espaços vazios. No entanto, algumas partículas a sofreram desvio significativo, indicando a presença de uma região central densa e carregada positivamente, o núcleo.
Além disso, Rutherford concluiu que a carga negativa na eletrosfera é distribuída de forma uniforme, para que o átomo seja eletricamente neutro. Essa distribuição de carga negativa ao redor do núcleo é o que mantém a estabilidade do átomo.
Apesar de ter contribuído significativamente para o entendimento da estrutura atômica, o modelo de Rutherford também apresentava algumas limitações. Por exemplo, de acordo com as leis da eletrodinâmica da época, uma partícula carregada negativamente em aceleração constante deveria emitir energia radiante e, assim, perder energia e colapsar em direção ao núcleo. Isso implica que os átomos seriam instáveis e, portanto, o modelo de Rutherford não conseguia explicar por que os átomos não colapsavam.
Essa limitação foi superada posteriormente com o desenvolvimento do modelo atômico de Bohr, que introduziu a ideia de orbitais eletrônicos quantizados, onde os elétrons poderiam ocupar apenas determinadas órbitas ao redor do núcleo, evitando assim o colapso do átomo. No entanto, o modelo de Rutherford ainda foi um importante avanço na compreensão da estrutura atômica e abriu caminho para pesquisas posteriores sobre a natureza da matéria.