Números Quânticos: principal, secundário, magnético e de spin
A distribuição eletrônica em orbitais descreve como os elétrons são organizados nos diferentes níveis e subníveis de energia em torno do núcleo de um átomo. Essa distribuição é baseada nos quatro números quânticos: número quântico principal (n), número quântico secundário (l), número quântico magnético (m) e número quântico de spin (s).
Número quântico principal (n)
Indica o nível de energia em que o elétron está localizado. Os valores possíveis para n são números inteiros maiores que zero (1, 2, 3, ...). Quanto maior o valor de "n", maior é o raio médio da órbita.
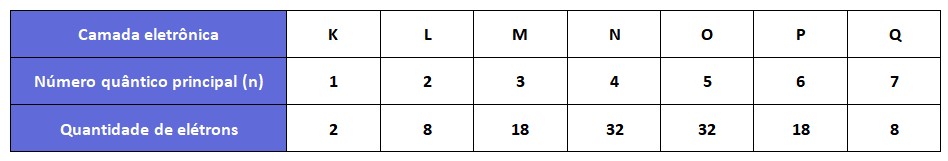
Número quântico secundário ou azimutal (l)
É representado pela letra "l" e indica o momento angular orbital de um elétron em um átomo. O valor de "l" varia de 0 a n-1, onde "n" é o número quântico principal.
Cada valor de número quântico secundário (ℓ) corresponde a um subnível específico dentro de um nível de energia. Por exemplo, quando "ℓ" = 0, o subnível é chamado de s, quando "ℓ" = 1, o subnível é chamado de "p", quando "ℓ" = 2, o subnível é chamado de d e quando o "ℓ" = 3, o subnivel é chamado de f.
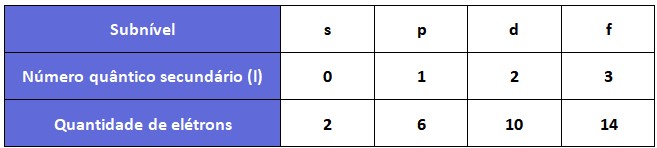
Tabela de relação dos número quântico secundário ou azimutal (ℓ)
Número quântico magnético (m)
Indica a orientação espacial do orbital em relação a um eixo de referência. Os valores possíveis para Número quântico magnético (m) dependem do valor do número quântico secundário (ℓ). Para cada valor de "ℓ", existem 2"ℓ"+1 valores possíveis para "m", variando de -1 a +1. Por exemplo, se "ℓ" for igual a 1, "m" pode ser -1, 0 ou +1.
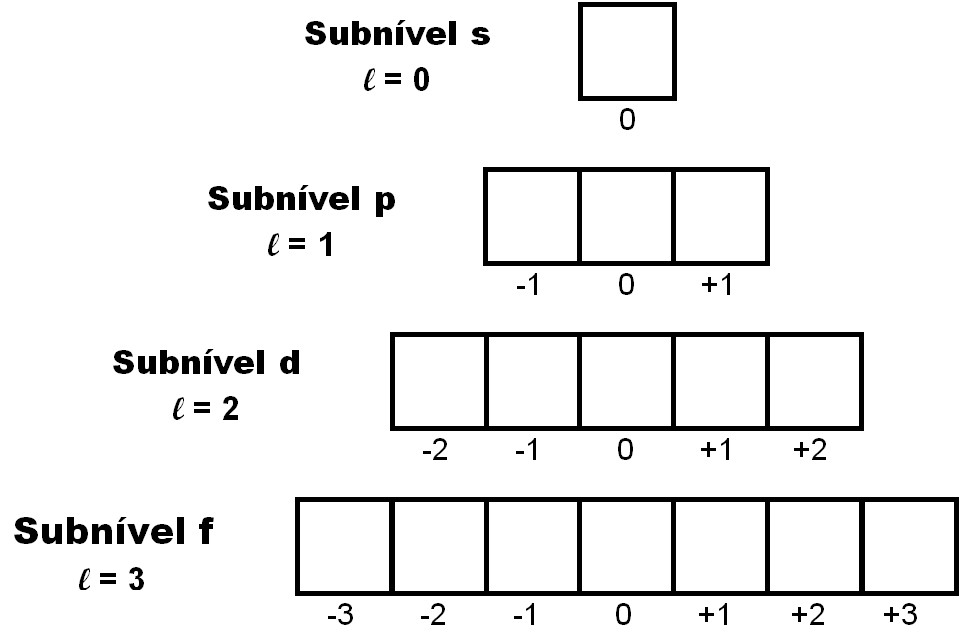
Número quântico de spin (s)
Indica a direção do spin do elétron. Os valores possíveis para "s" são -½ ou +½, representando o spin para cima e para baixo, respectivamente.
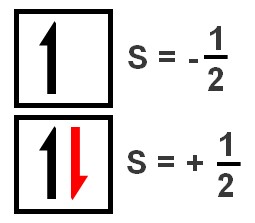
A regra de Pauling estabelece que cada elétron em um átomo deve ter um conjunto único de valores quânticos, o que significa que dois elétrons não podem ter todos os quatro números quânticos iguais.
Portanto, a distribuição eletrônica em orbitais segue uma ordem de preenchimento específica, conhecida como princípio de Aufbau. Os orbitais são preenchidos em ordem crescente de energia, de acordo com a sequência 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, e assim por diante. Cada orbital pode conter no máximo dois elétrons com spins opostos.
Por exemplo, a distribuição eletrônica do carbono (C) é 1s² 2s² 2p². Isso significa que o átomo de carbono possui 2 elétrons no orbital 1s, 2 elétrons no orbital 2s e 2 elétrons no orbital 2p.
Camada 2 (n = 2) ← 2 p 2
↓
Subnível p (ℓ = 1)
| ↑ | ↑ |
-1 0 +1
Esses três elétrons são chamado de elétrons desemparelhados.
n = 2: Número quântico principal
ℓ = 1: Número quântico secundário
mℓ = 0: Número quântico magnético
s ou ms = -½: Número quântico de spin
É importante ressaltar que a distribuição eletrônica em orbitais é uma maneira de organizar os elétrons em um átomo de acordo com as leis da mecânica quântica. Essa distribuição influencia as propriedades químicas e físicas dos elementos.