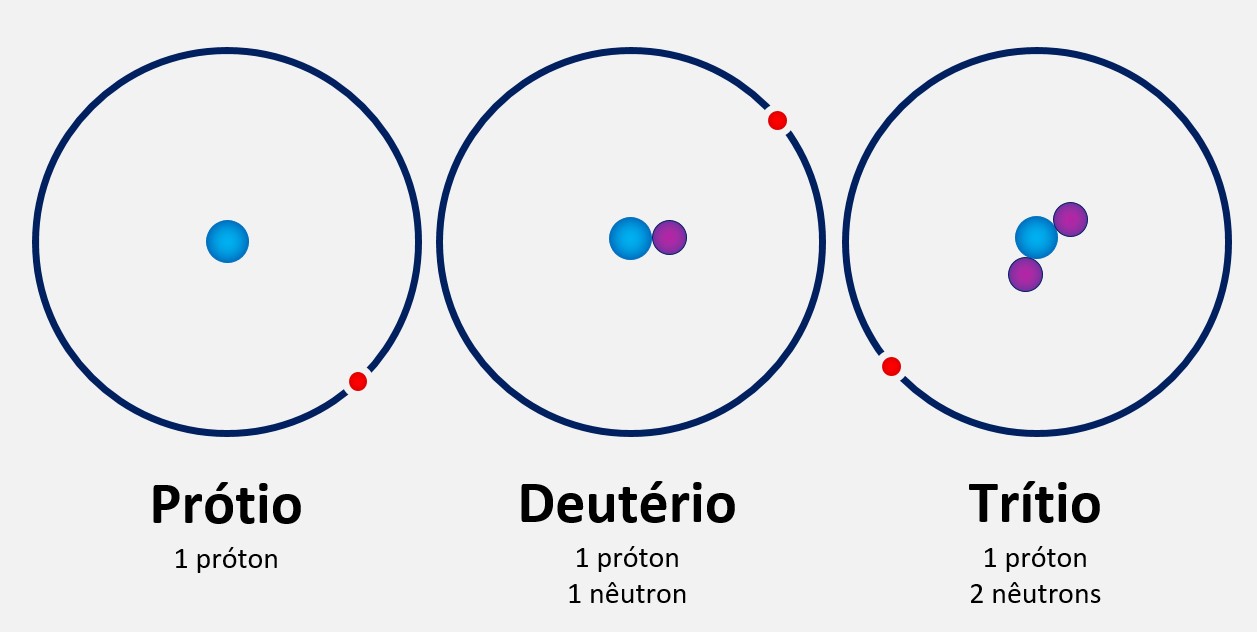
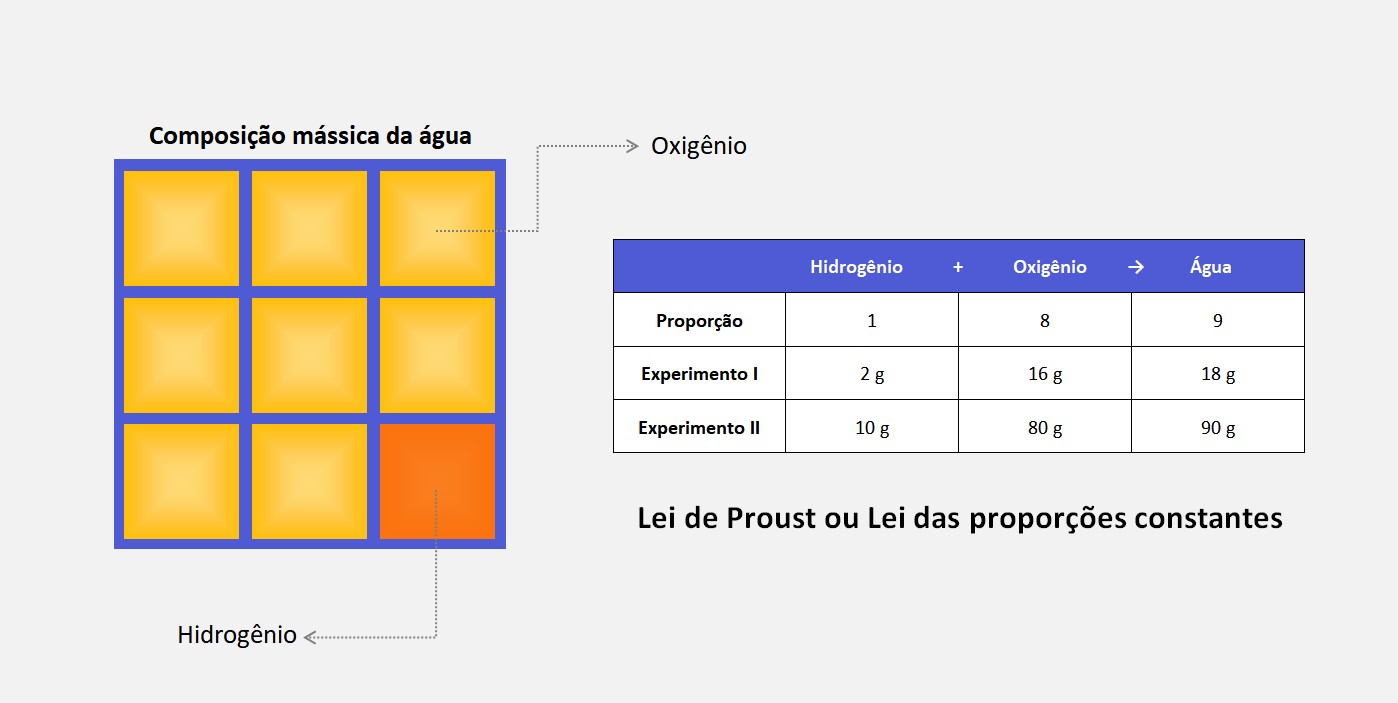
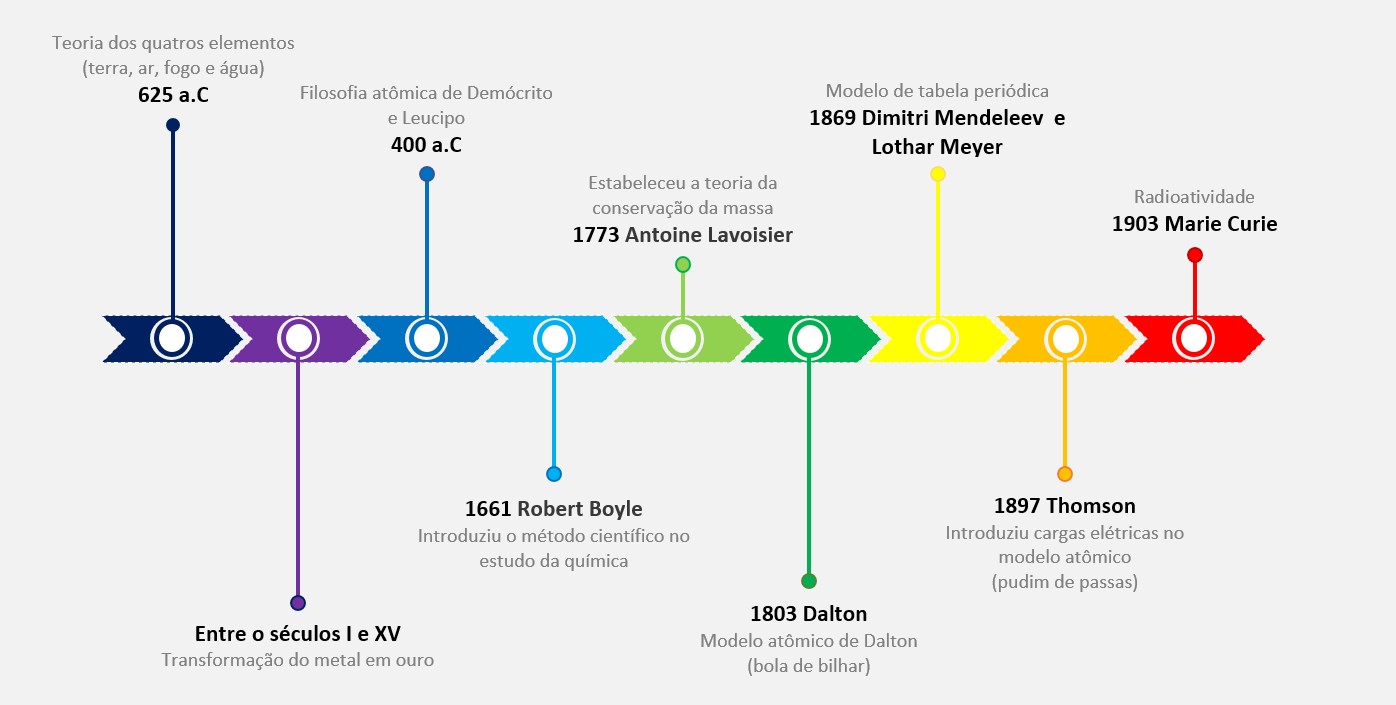
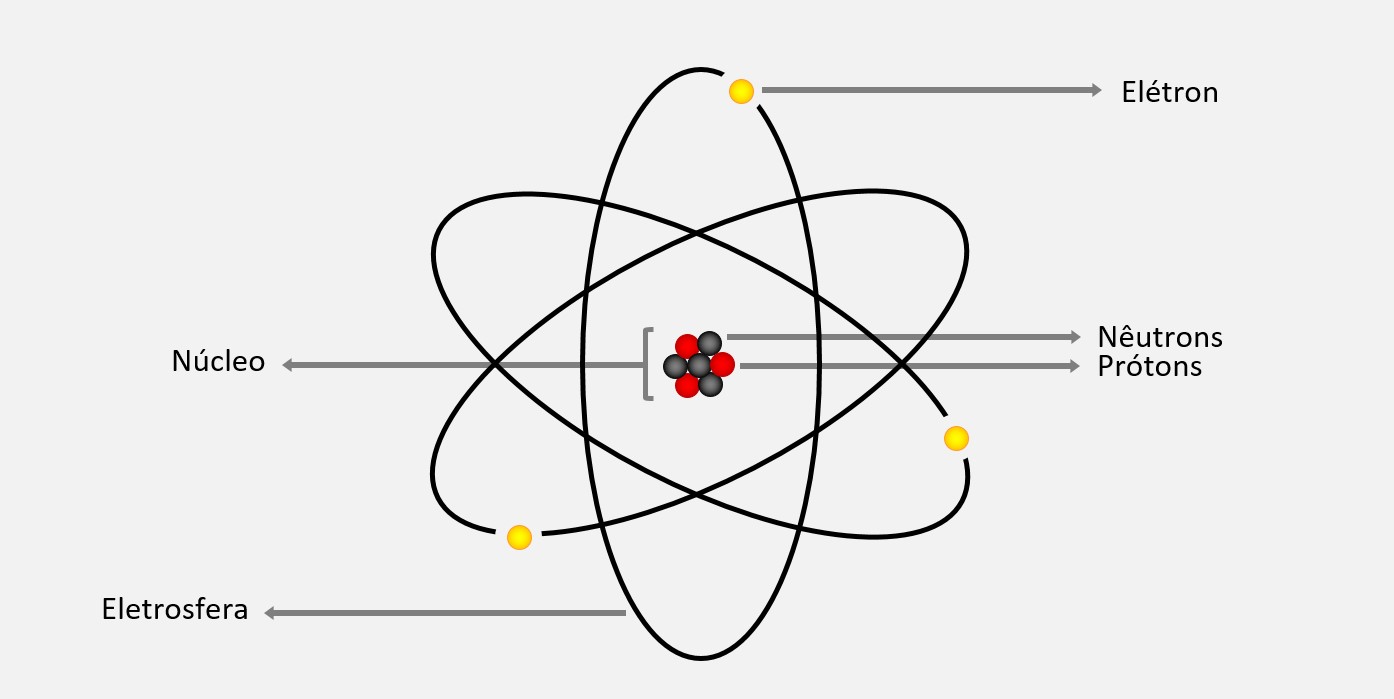
Modelo atômico de Thomson
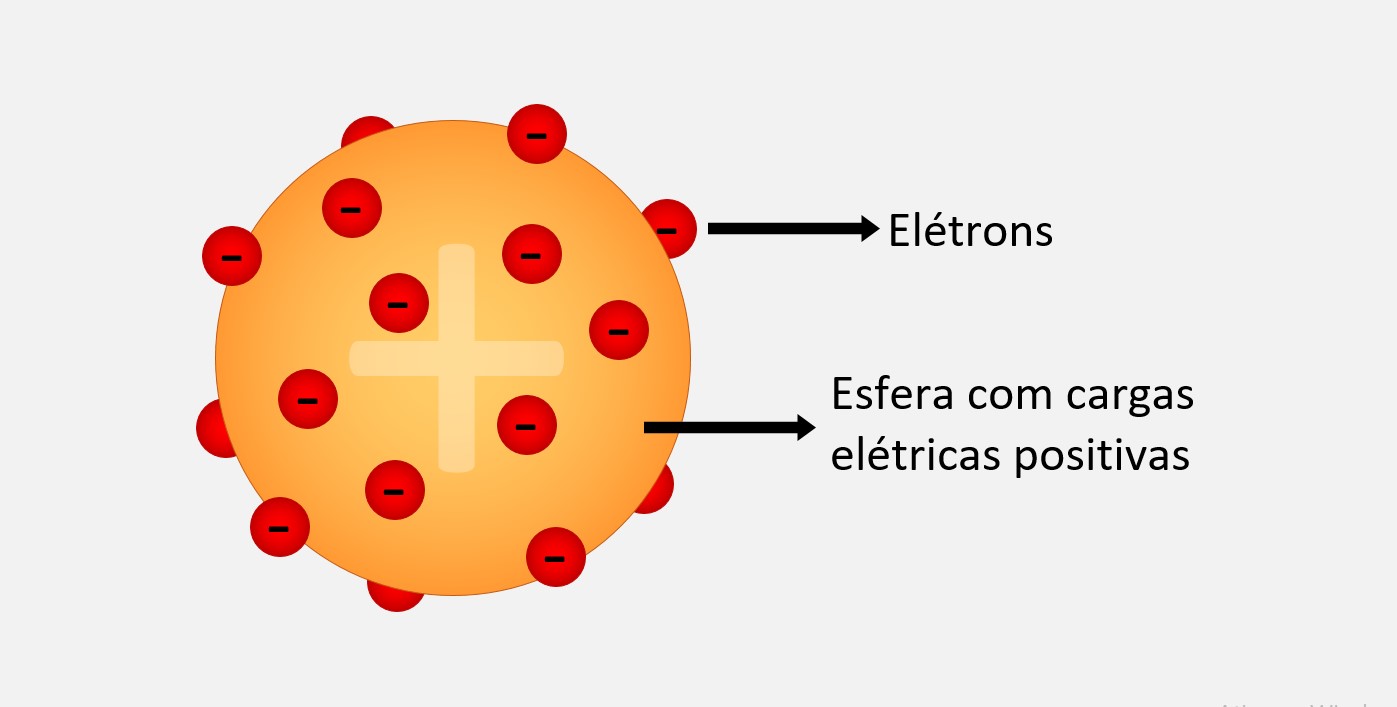
No modelo atômico de Thomson, o átomo era visto como uma esfera maciça, com cargas elétricas positivas (prótons) espalhadas uniformemente pelo seu interior e elétrons (partículas negativas) dispersos de forma aleatória por essa nuvem positiva. Esse modelo foi conhecido como "modelo do pudim de passas". Esse modelo foi revolucionário na época, pois derrubou a ideia de que o átomo era uma partícula indivisível e homogênea. Ele também ajudou a explicar alguns fenômenos observados experimentalmente, como a condutividade elétrica em soluções e gases.
Essa descoberta teve um impacto significativo no modelo atômico proposto por Thomson. Ele sugeriu que os átomos eram compostos por um fluido positivo, no qual os elétrons estavam dispersos de forma uniforme. No entanto, o modelo de Thomson tinha algumas limitações. Por exemplo, ele não explicava a estabilidade dos átomos, já que o movimento dos elétrons nessa nuvem positiva deveria causar um colapso do átomo. Além disso, não fornecia uma explicação para a existência de diferentes elementos, cada um com suas propriedades distintas.
Apesar dessas limitações, o modelo de Thomson foi um marco importante no estudo da estrutura atômica e estabeleceu a base para os modelos posteriores propostos por cientistas como Ernest Rutherford e Niels Bohr, que trouxeram avanços significativos na compreensão da estrutura e comportamento dos átomos.
Além disso, o modelo de Thomson também desempenhou um papel fundamental no desenvolvimento da teoria da eletricidade, pois estabeleceu a existência de partículas subatômicas carregadas negativamente, os elétrons, que são fundamentais para entender os fenômenos elétricos. Os avanços na compreensão do átomo e sua estrutura ao longo do tempo têm sido fundamentais para o desenvolvimento da química, física e outras áreas da ciência. Eles nos permitiram entender a natureza da matéria e suas propriedades, e abriram caminho para muitas descobertas e aplicações científicas e tecnológicas.
O modelo de Thomson foi um avanço significativo na compreensão do átomo, mas foi posteriormente substituído pelo modelo de Rutherford, que propôs a existência de um núcleo pequeno e denso, no qual estão concentradas a maior parte da massa e carga positiva do átomo, enquanto os elétrons orbitam ao redor do núcleo em órbitas determinadas.
Atualmente, o modelo mais aceito é o modelo da mecânica quântica, que descreve os elétrons como partículas e ondas, com suas posições representadas por uma nuvem de probabilidade eletrônica, descrito pela função de onda de Schrödinger. Esse modelo descreve com maior precisão a distribuição dos elétrons em torno do núcleo e os níveis de energia possíveis para eles.