Movimento de moléculas gasosas
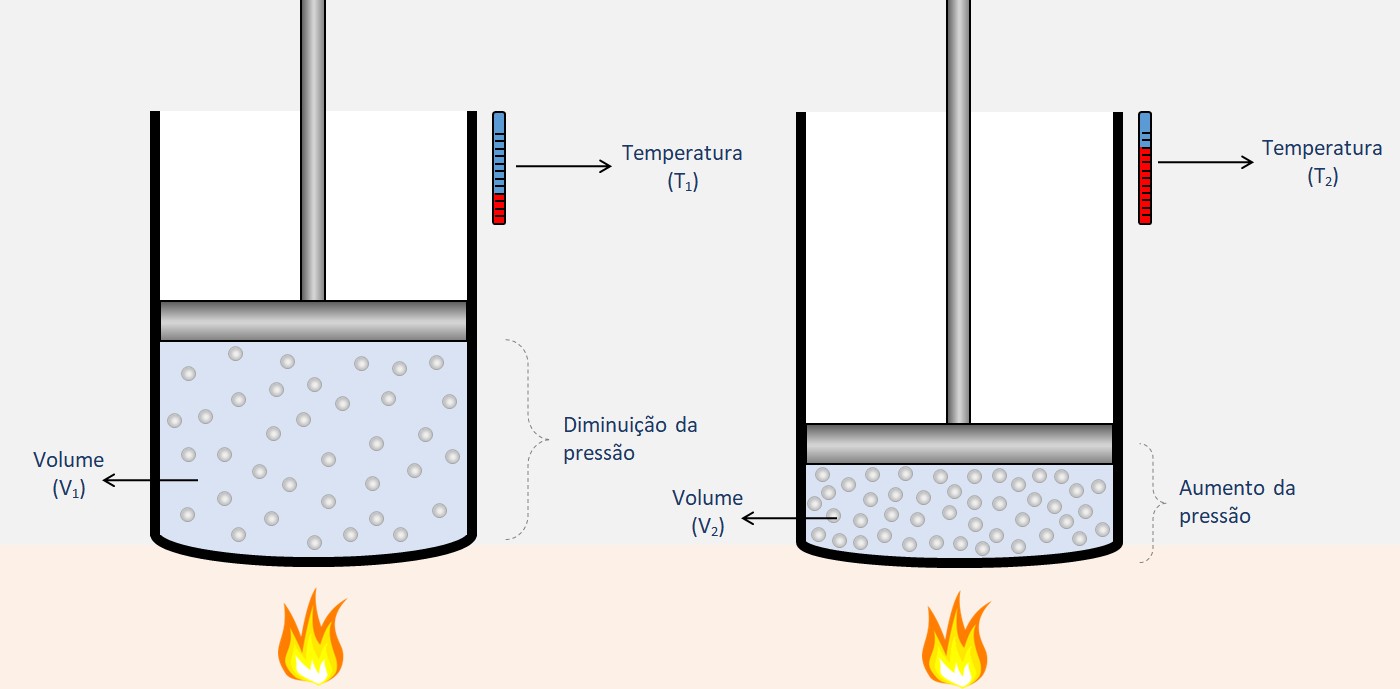
O movimento de moléculas gasosas refere-se à movimentação aleatória e contínua das partículas individuais que compõem um gás. Essas moléculas estão em constante movimento, colidindo umas com as outras e com as paredes do recipiente em que estão contidas.
Esse movimento está intimamente relacionado à temperatura do sistema. À medida que a temperatura aumenta, as moléculas se movem mais rapidamente e suas colisões se tornam mais frequentes e energéticas. Por outro lado, ao diminuir a temperatura, o movimento molecular diminui, tornando-se mais lento.
O movimento das moléculas gasosas é caracterizado por alguns comportamentos:
1. Velocidade média: As moléculas de um gás têm velocidades variáveis, mas a velocidade média é diretamente proporcional à temperatura absoluta do gás.
2. Colisões: As moléculas se deslocam em linha reta até que colidam umas com as outras ou com as paredes do recipiente. Essas colisões são elásticas, o que significa que não há perda de energia durante a colisão.
3. Distribuição de velocidades: As velocidades das moléculas de um gás seguem uma distribuição estatística, conhecida como distribuição de velocidades de Maxwell-Boltzmann. Essa distribuição descreve a probabilidade de diferentes velocidades ocorrerem em um dado sistema gasoso.
4. Movimento aleatório: As moléculas de um gás estão em constante movimento aleatório, sem seguir um padrão específico. Isso significa que as moléculas têm uma grande liberdade de movimento e podem ocupar todo o espaço disponível no recipiente.
O movimento molecular é um aspecto fundamental para entender o comportamento dos gases, pois está relacionado a propriedades como pressão, volume e temperatura. As leis dos gases ideais, como a Lei de Boyle, a Lei de Charles e a Lei de Gay-Lussac, descrevem o comportamento dos gases com base no movimento de suas moléculas.