Lei dos Gases
Pnormal = 1 atm = 760 mmHg ≅ 100 kPa
Tnormal = O ºC = 273 K
Essas condições são utilizadas para padronizar medidas e cálculos, permitindo a comparação de propriedades entre diferentes substâncias. É importante ressaltar que as CNTP são válidas somente para gases, pois em líquidos e sólidos as propriedades são influenciadas pela temperatura e pressão de forma mais significativa.
A Lei dos Gases Ideais é uma relação matemática que descreve o comportamento dos gases em condições ideais. De acordo com essa lei, um gás ideal é aquele que obedece a certas condições, tais como ser formado por partículas puntiformes (sem volume), estar em movimento aleatório e suas colisões serem perfeitamente elásticas.
A lei dos gases ideais pode ser expressa matematicamente de diferentes formas, mas a forma mais comum é a Equação de Estado dos Gases Ideais, que relaciona a pressão (P), o volume (V), a temperatura (T) e a quantidade de substância (n) de um gás ideal:
PV = nRT
onde:
P = pressão do gás em Pascal (Pa)
V = volume do gás em metros cúbicos (m3)
n = número de mols do gás
R = constante dos gases ideais (8,314 J/mol·K) ou R = 0,082 (medida em atmosferas (atm), volume em litros (L) e a temperatura em Kelvin (K))
T = temperatura absoluta em Kelvin (K)
Essa equação permite relacionar essas grandezas e realizar cálculos envolvendo diferentes variáveis, como calcular a massa molar de um gás desconhecido, determinar o volume ocupado por um certo número de mols de gás a uma certa pressão e temperatura, ou ainda determinar a pressão de um gás quando o volume e a temperatura são conhecidos.
No entanto, é importante destacar que essa lei é uma aproximação idealizada do comportamento dos gases, sendo válida em condições de baixa pressão e alta temperatura. Em condições extremas, como altas pressões e baixas temperaturas, os desvios em relação à lei dos gases ideais podem ser significativos.
Conversão de temperatura:
Temperaturak = Temperatura°C + 273
Conversão de número de mol:
n = m / MM
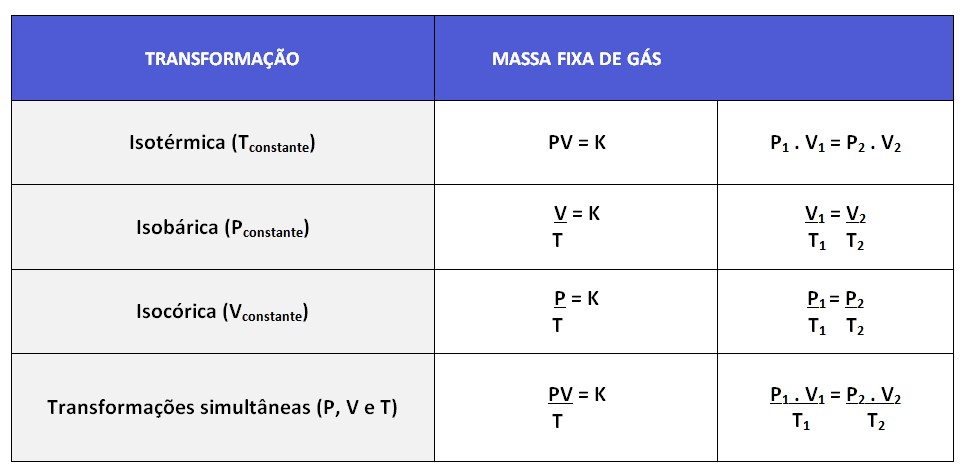
As transformações gasosas referem-se às mudanças que ocorrem nas propriedades de um gás quando ele é submetido a diferentes condições de pressão, volume e temperatura. Existem diferentes tipos de transformações gasosas, que são:
1. Transformação Isotérmica: Nessa transformação, a temperatura do gás é mantida constante. Como resultado, a pressão do gás é inversamente proporcional ao volume (Lei de Boyle).
Exemplo: compressão ou expansão de um gás em um recipiente fechado a uma temperatura constante.
2. Transformação Isobárica: Nessa transformação, a pressão do gás é mantida constante. Dessa forma, o volume do gás é diretamente proporcional à temperatura (Lei de Charles e Gay-Lussac).
Exemplo: aquecimento ou resfriamento de um gás em um recipiente mantendo a pressão constante.
3. Transformação Isocórica, também chamada de transformação isométrica ou isovolumétrica: Nessa transformação, o volume do gás é mantido constante. Portanto, a pressão do gás é diretamente proporcional à temperatura (Gay-Lussac).
Exemplo: aquecimento de um gás confinado a um volume fixo.
Essas são apenas algumas das transformações gasosas mais comuns. É importante entender as leis dos gases ideais e como elas se aplicam a cada tipo de transformação para analisar e calcular as mudanças nas propriedades dos gases. Além disso, vale ressaltar que em qualquer transformação gasosa, a quantidade de gás (número de mols) deve ser mantida constante, a menos que haja uma reação química envolvida.
P1 . V1 = P2 . V2
T1 T2
Transformação Isotérmica: retira o T
Transformação Isobárica: retira o P
Transformação Isocórica: retira o V
A fórmula para a energia cinética, que é a energia associada ao movimento de um objeto, é dada por:
Energia Cinética
E = m . v2
2
onde:
E = é a energia cinética em joules (J)
m = é a massa do objeto em quilogramas (kg)
v = é a velocidade do objeto em metros por segundo (m/s)
Essa fórmula mostra que a energia cinética é diretamente proporcional à massa e ao quadrado da velocidade do objeto. Isso significa que, à medida que a massa do objeto aumenta ou sua velocidade aumenta, a energia cinética também aumenta.