Lei de Charles e Gay-Lussac
A Lei de Charles e Gay-Lussac é uma das leis dos gases ideais que descreve a relação entre a temperatura e o volume de um gás, mantendo a pressão constante (para uma quantidade fixa de gás).
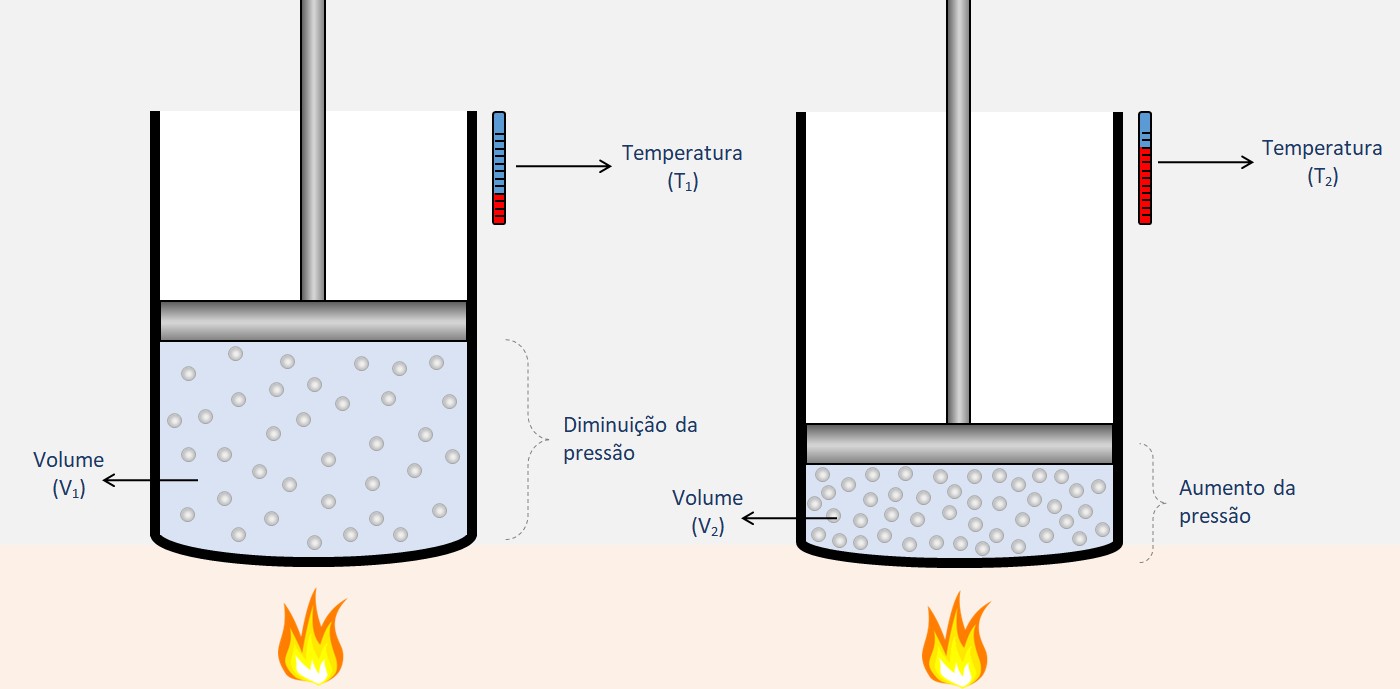
Segundo essa lei, o volume de um gás é diretamente proporcional à sua temperatura absoluta, desde que a pressão seja mantida constante. Em outras palavras, se a temperatura de um gás aumentar, seu volume também aumentará, e se a temperatura diminuir, o volume do gás diminuirá, desde que a pressão seja mantida constante.
Essa relação pode ser expressa matematicamente da seguinte forma:
V / T = K
ou
V1 / T1 = V2 / T2
onde V1 e T1 representam o volume e a temperatura iniciais do gás, respectivamente, e V2 e T2 representam o volume e a temperatura finais após a mudança.
Essa lei foi formulada por Jacques Charles e Joseph-Louis Gay-Lussac no final do século XVIII. Ela é uma das leis fundamentais da termodinâmica e é amplamente utilizada para descrever o comportamento dos gases em relação à temperatura e volume, mantendo a pressão constante.
É importante ressaltar que a Lei de Charles e Gay-Lussac é válida apenas para gases ideais, que obedecem a certas condições ideais, tais como serem compostos por partículas puntiformes (sem volume) e se comportarem de forma ideal.