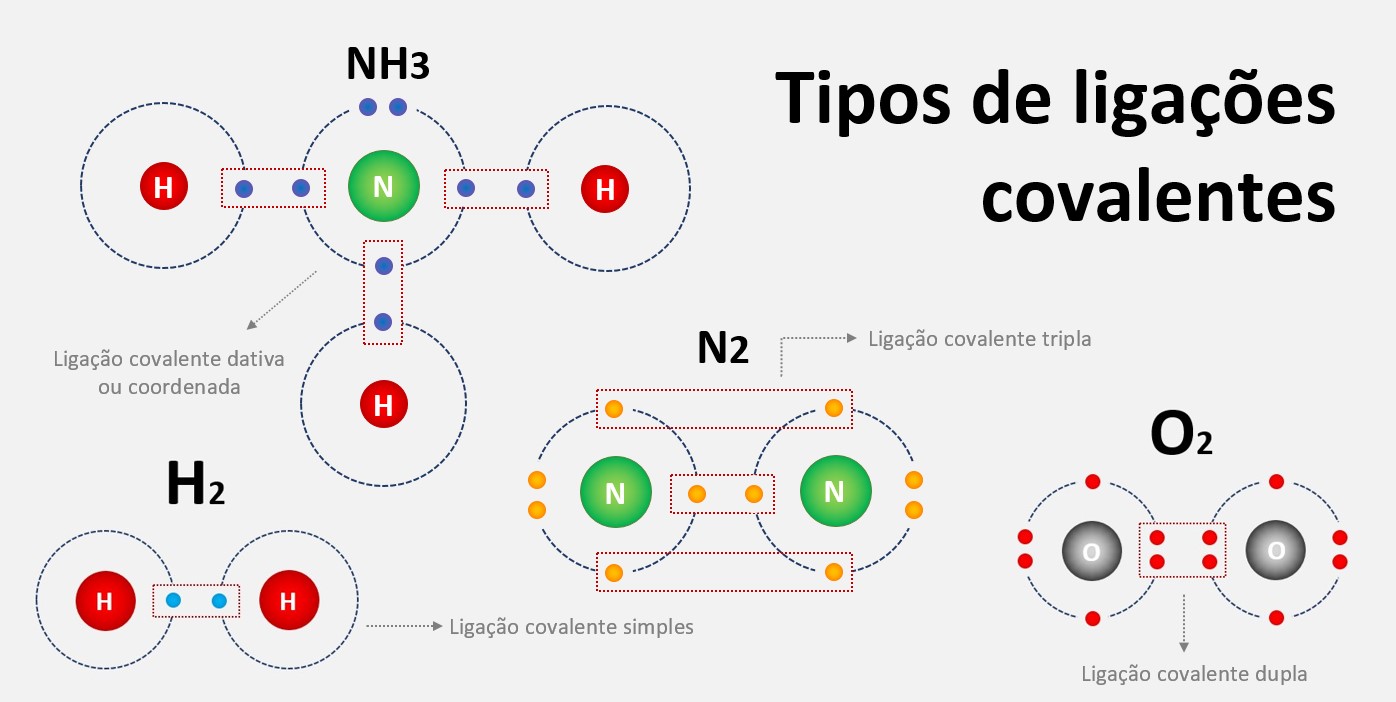
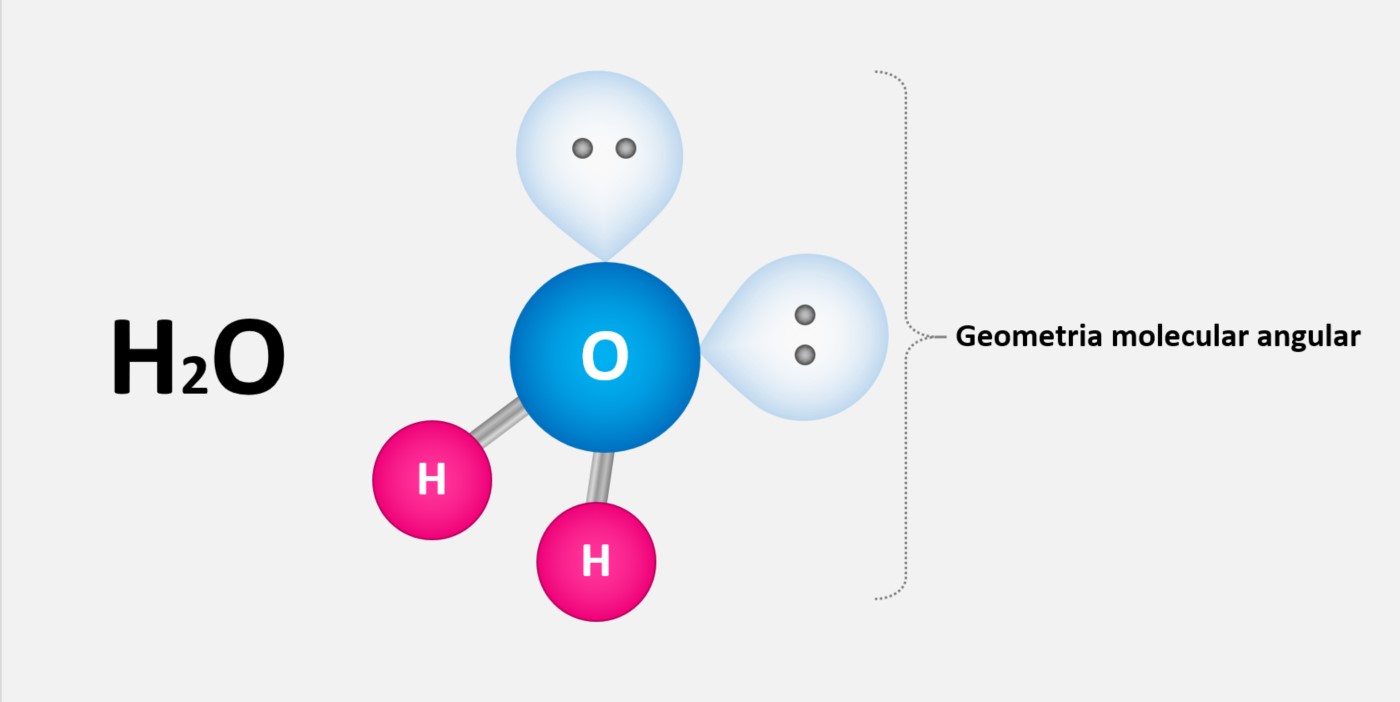
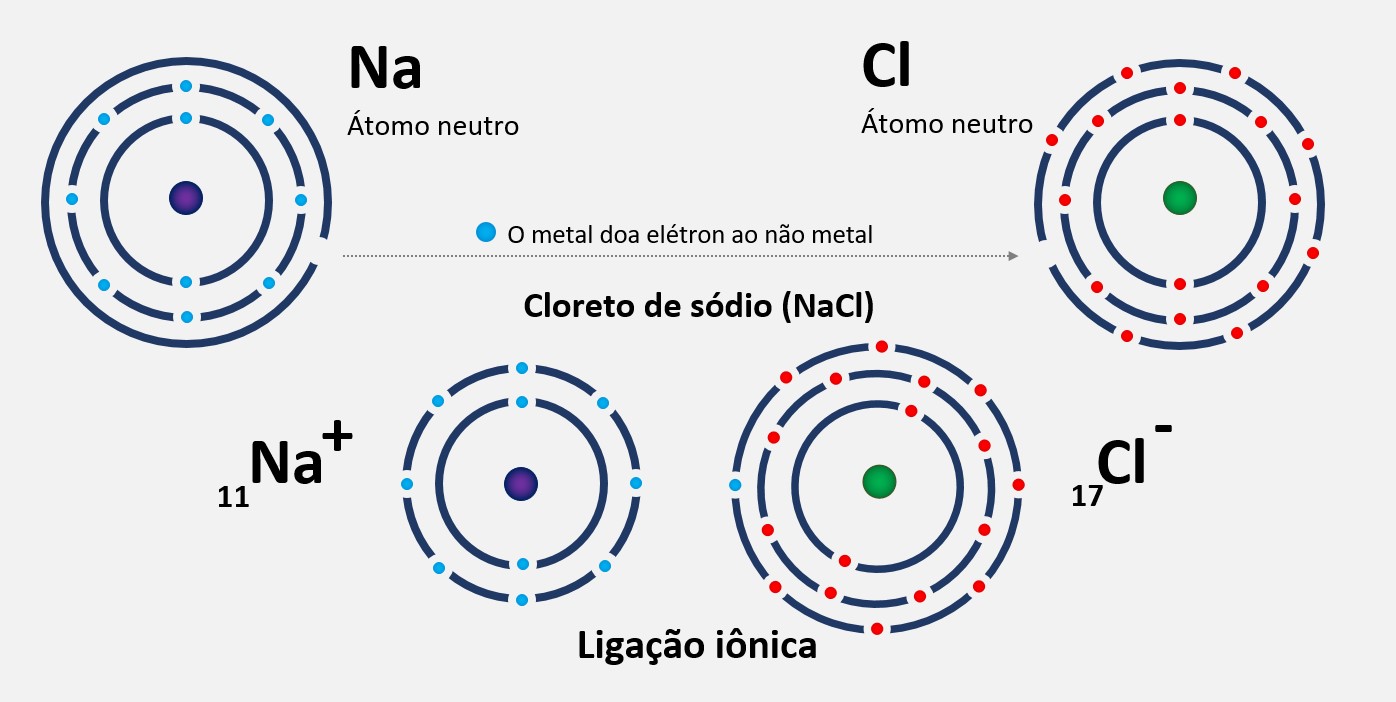
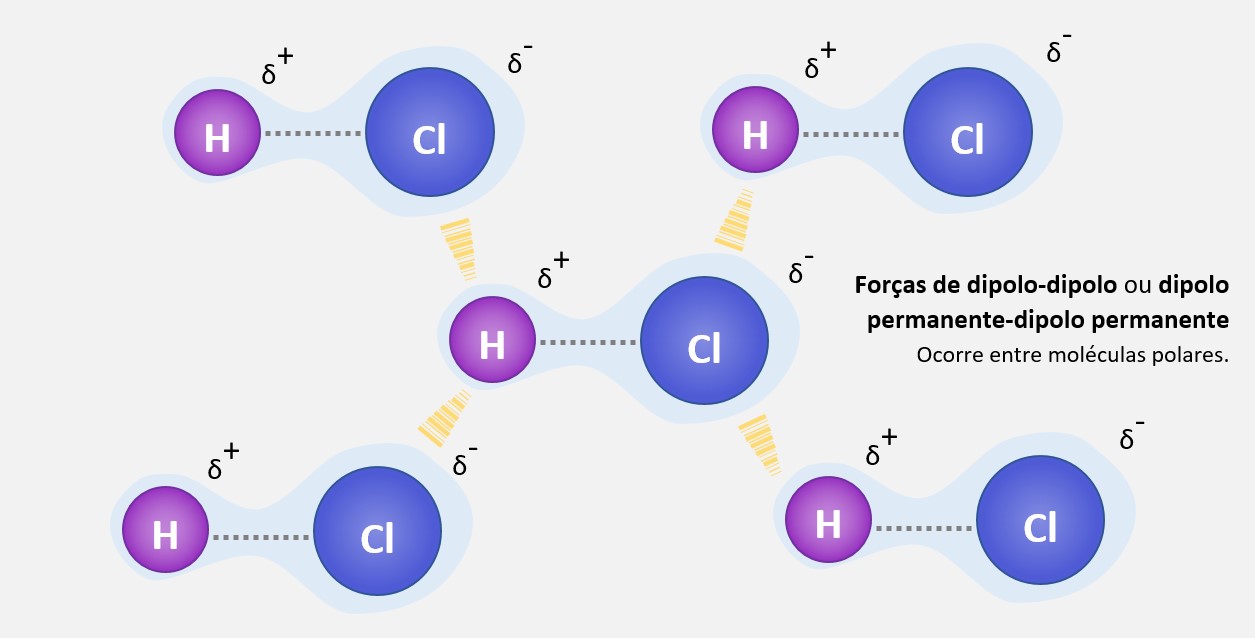
Regra do octeto
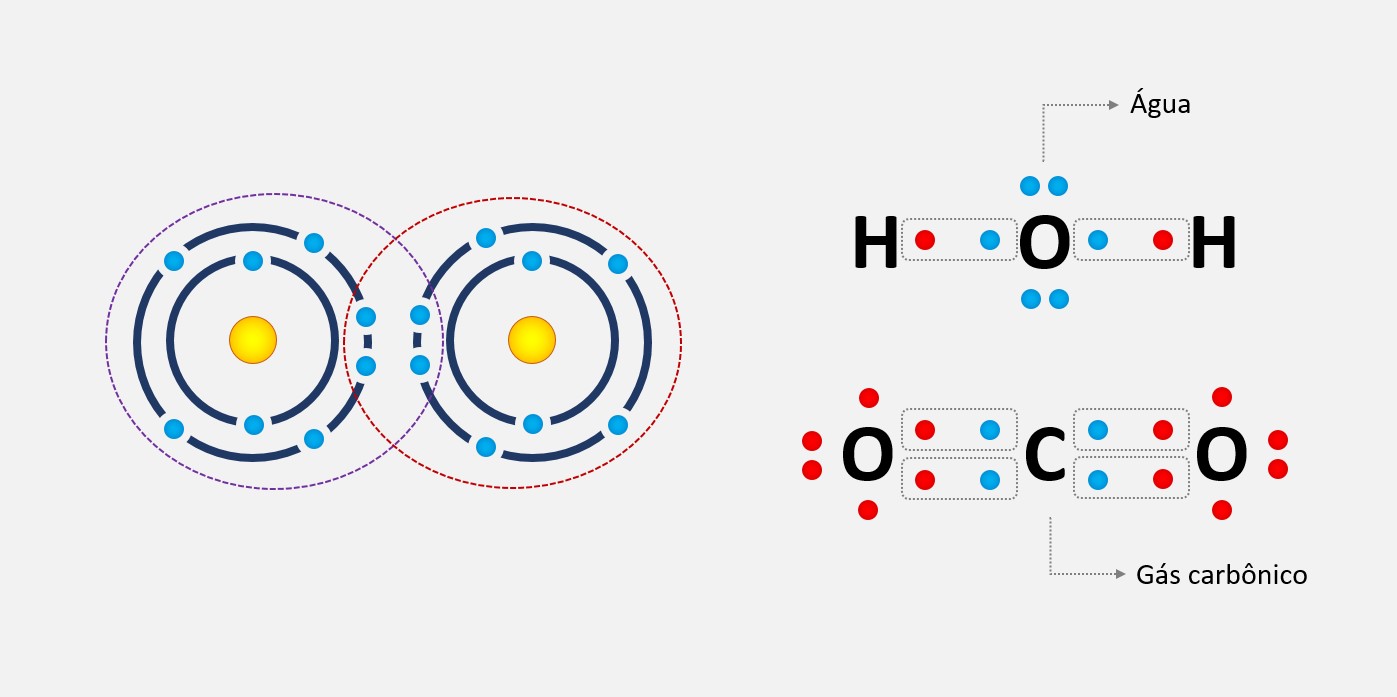
A regra do octeto é uma regra química que estabelece que os átomos tendem a ganhar, perder ou compartilhar elétrons até alcançarem 8 elétrons na camada de valência, ficando com uma configuração eletrônica semelhante à do gás nobre mais próximo na tabela periódica.
Essa regra é válida para a maioria dos elementos químicos, exceto para os elementos de número atômico baixo, como o hidrogênio e o hélio, que tendem a ganhar ou perder apenas 2 elétrons para alcançarem a configuração do gás nobre mais próximo. Essa regra é fundamental para entender como os átomos se ligam uns aos outros e formam moléculas ou compostos.
A contração do octeto ocorre nos elementos berílio (Be), boro (B) e alumínio (Al). Esses elementos são exceções à regra do octeto devido ao seu número limitado de elétrons na camada de valência.
O berílio possui apenas dois elétrons em sua camada de valência e, portanto, tende a perder esses dois elétrons para alcançar uma configuração de gás nobre estável. Isso resulta em uma configuração eletrônica de Be+2.
O boro possui três elétrons na camada de valência e, assim como o berílio, tende a perder esses três elétrons. Isso resulta em uma configuração eletrônica de B+3.
O alumínio possui três elétrons na camada de valência, mas, ao contrário do berílio e do boro, tende a perder apenas três elétrons. Isso resulta em uma configuração eletrônica de Al+3.
Essas contrações do octeto ocorrem porque esses elementos têm uma estrutura eletrônica relativamente estável mesmo com menos de oito elétrons na camada de valência. A perda desses elétrons resulta em uma configuração eletrônica mais estável, sem a necessidade de adquirir elétrons extras para completar o octeto.
O fósforo (P) e o enxofre (S) são elementos que podem exibir octeto expandido, o que significa que podem ter mais do que oito elétrons na camada de valência.
O fósforo, por exemplo, possui uma camada de valência com cinco elétrons. Para atingir a estabilidade, o fósforo é capaz de aceitar três elétrons extras para preencher seus orbitais d, permitindo assim um octeto expandido com dez elétrons na camada de valência. Isso resulta em íons fosfato (PO4) com carga -3.
Já o enxofre possui uma camada de valência com seis elétrons. Em alguns casos, o enxofre é capaz de compartilhar elétrons com elementos como o oxigênio, formando ligações de covalente dupla ou tripla que permitem que a camada de valência do enxofre acomode mais do que oito elétrons.
É importante ressaltar que nem todos os átomos de fósforo ou enxofre exibem um octeto expandido. Isso ocorre apenas em certas situações específicas e depende das condições e compostos envolvidos na reação química.
Algumas moléculas contêm um número ímpar de elétrons na camada de valência, e essas moléculas não podem seguir a regra do octeto de forma completa. Isso ocorre principalmente em moléculas que apresentam íons ou radicais livres.
Nos íons, o número total de elétrons em uma molécula pode ser ímpar devido ao ganho ou perda de elétrons. Por exemplo, o íon nitrito (NO2-) possui 17 elétrons, sendo um número ímpar, e não pode seguir a regra do octeto.
Os radicais livres são moléculas que têm um elétron não emparelhado, resultando em um número ímpar de elétrons. Um exemplo é o radical hidroxila (OH.), que tem sete elétrons.
Essas moléculas com número ímpar de elétrons na camada de valência são consideradas estáveis porque têm elétrons desemparelhados disponíveis para formar ligações químicas. Embora essas moléculas não obedeçam à regra do octeto, elas ainda podem ser quimicamente ativas e participar de reações químicas.