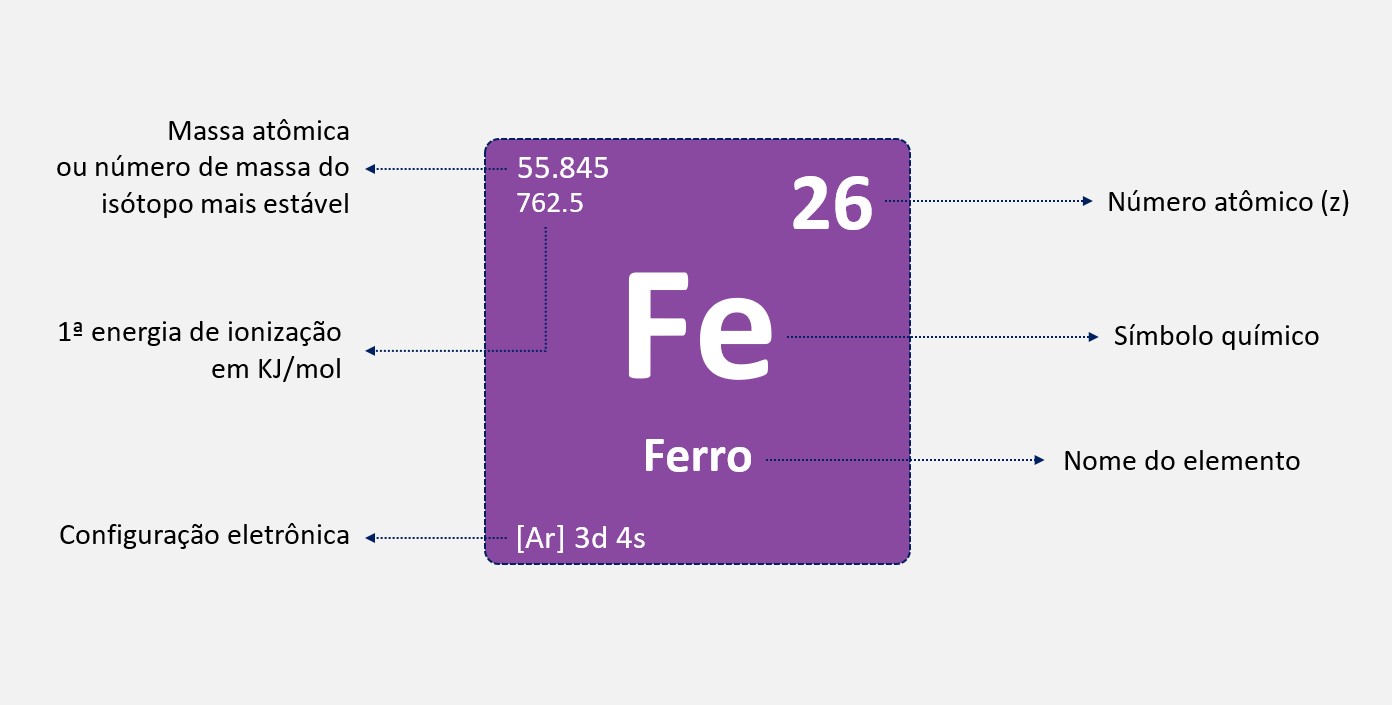
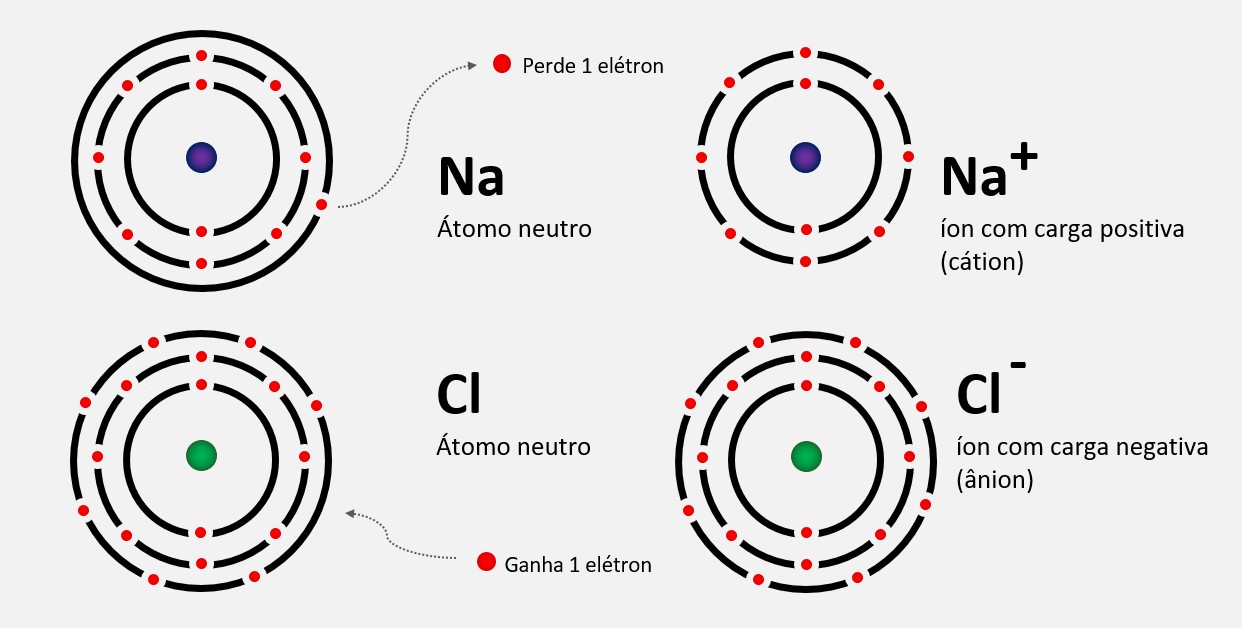
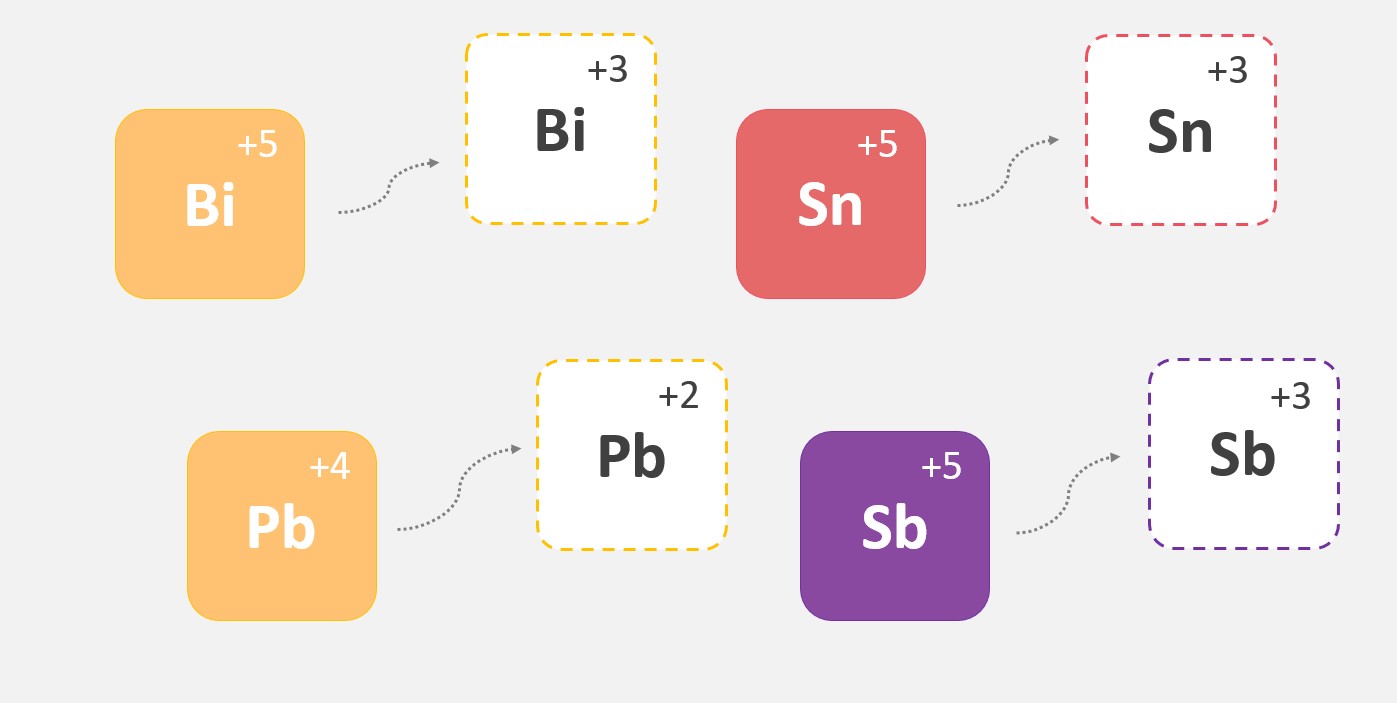
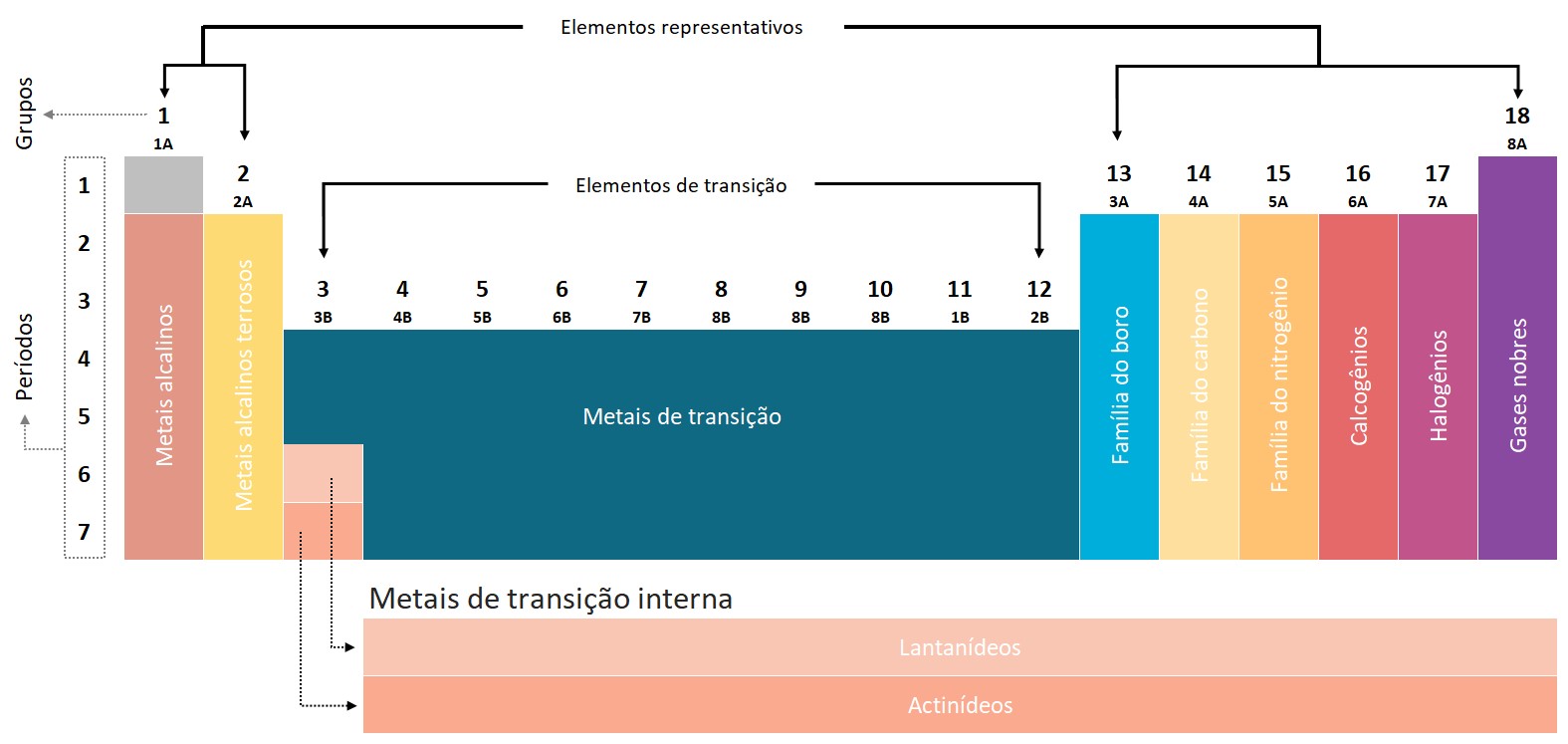
Energia de ionização ou potencial de ionização
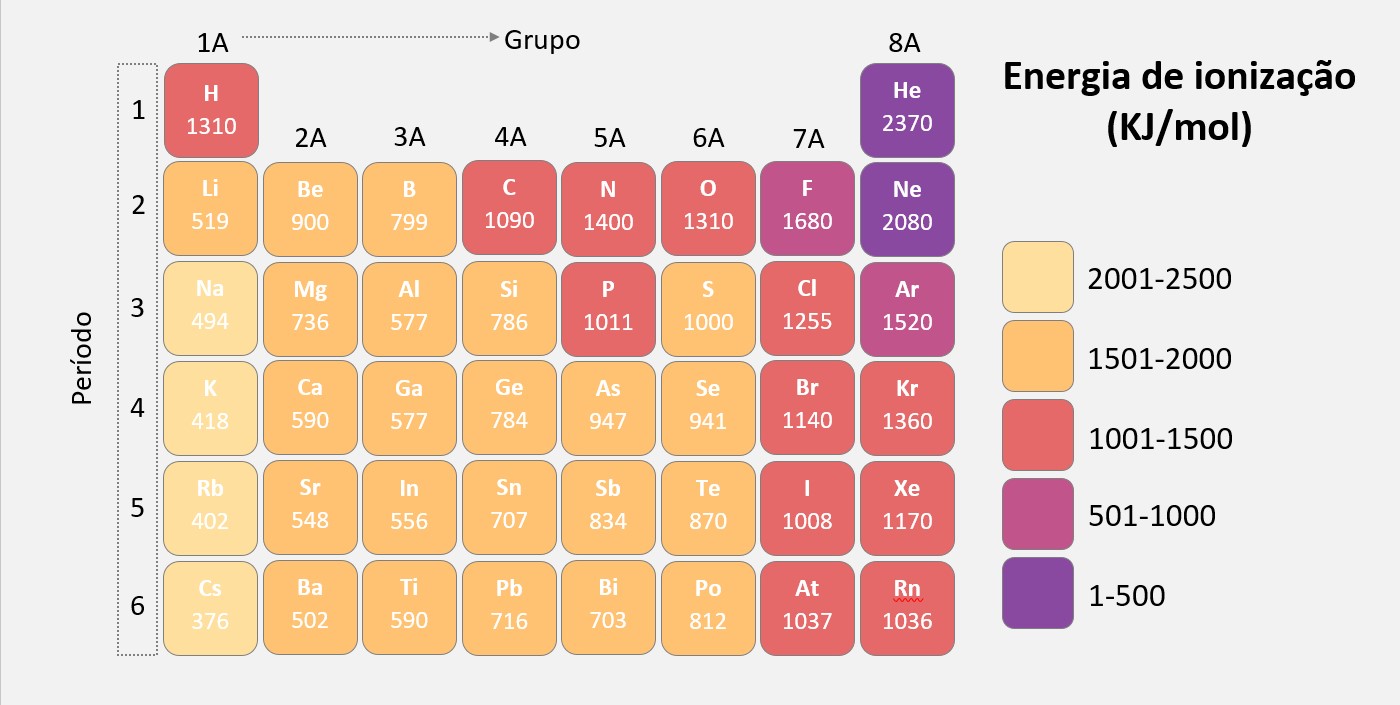
Energia de ionização, também conhecida como potencial de ionização, é a quantidade de energia necessária para remover um elétron de um átomo ou íon gasoso no seu estado fundamental.
A energia de ionização varia de átomo para átomo e depende de vários fatores, incluindo o número de prótons no núcleo do átomo, raio atômico, distribuição dos elétrons em orbitais e os efeitos de blindagem dos elétrons internos.
A primeira energia de ionização é a energia necessária para remover o primeiro elétron de um átomo neutro na sua forma gasosa. As energias de ionização subsequentes aumentam à medida que mais elétrons são removidos, porque a carga nuclear efetiva percebida pelos elétrons remanescentes aumenta. Isso ocorre porque a carga positiva do núcleo atrai mais fortemente os elétrons restantes.
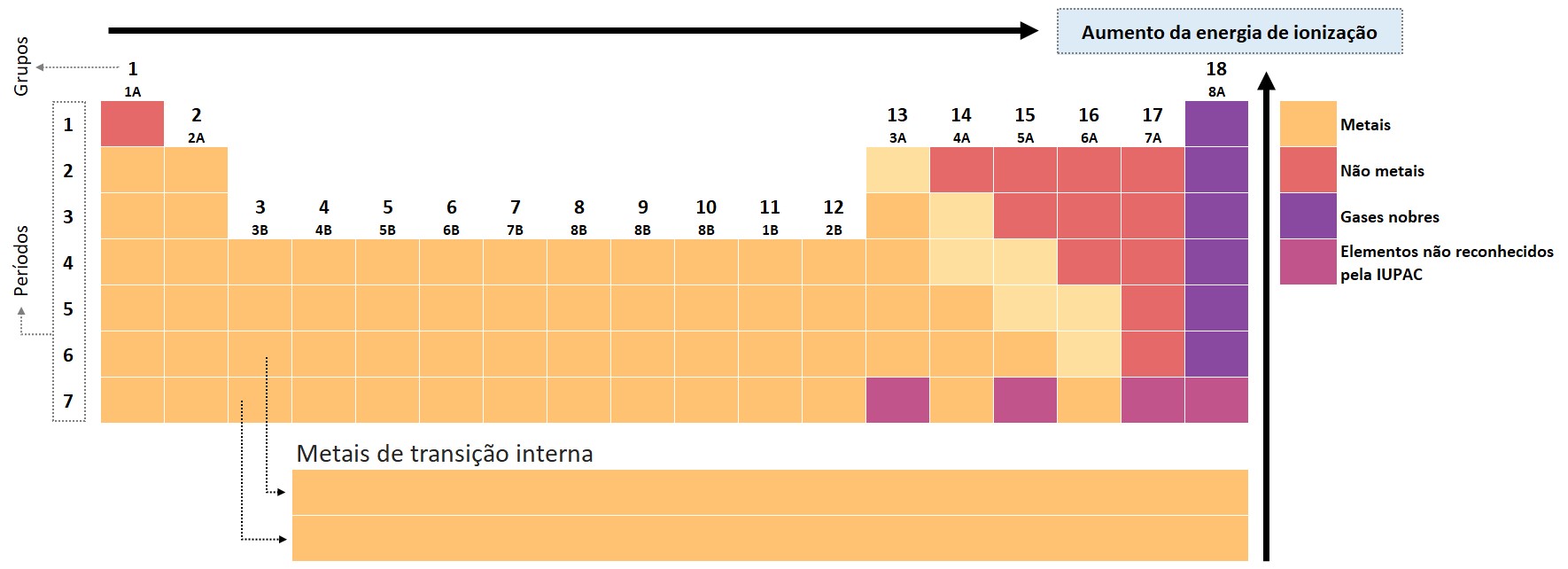
A energia de ionização é uma propriedade periódica, o que significa que segue uma tendência previsível na tabela periódica. Normalmente, a energia de ionização diminui à medida que se move de cima para baixo em um grupo, devido ao aumento do raio atômico e à maior distância entre o elétron e o núcleo.
A energia de ionização é uma propriedade importante, pois influencia a reatividade dos átomos e íons. Elementos com altas energias de ionização tendem a ser menos reativos, uma vez que é mais difícil remover elétrons desses átomos. Por outro lado, elementos com baixas energias de ionização tendem a ser mais reativos, já que é mais fácil remover seus elétrons.