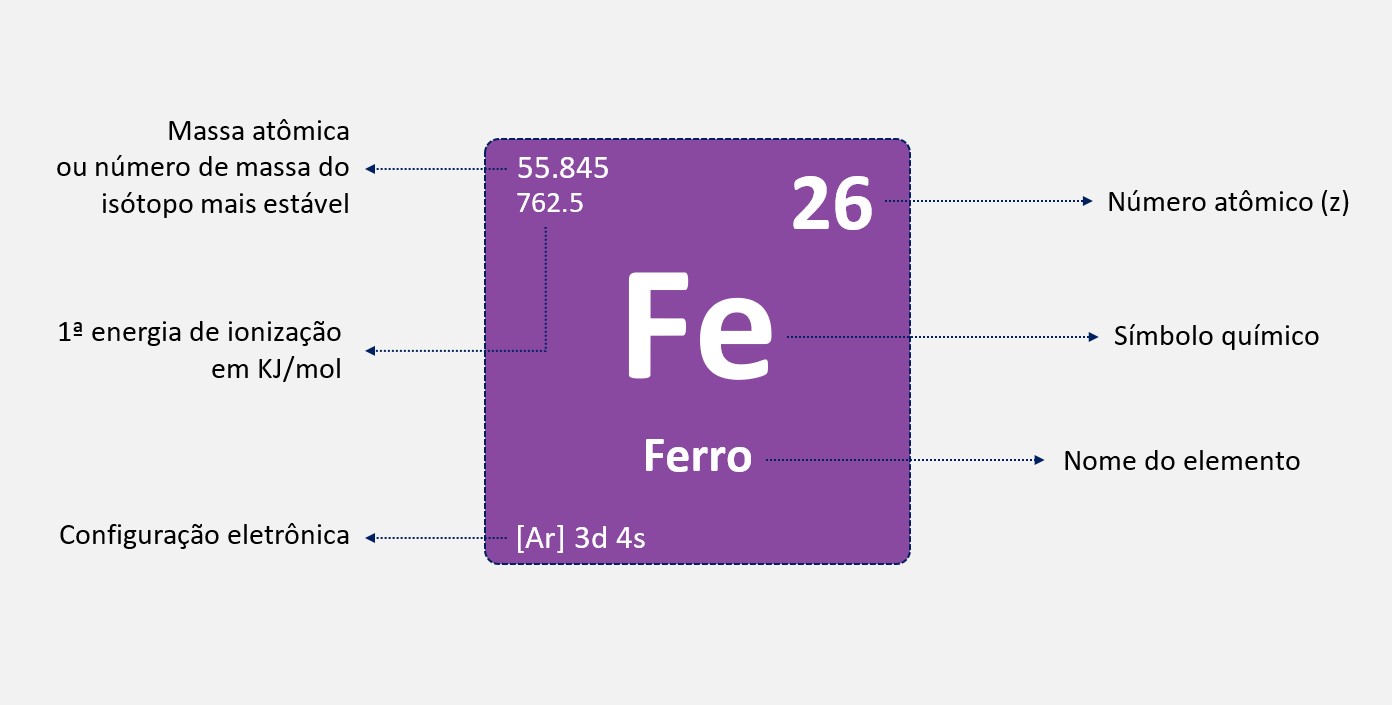
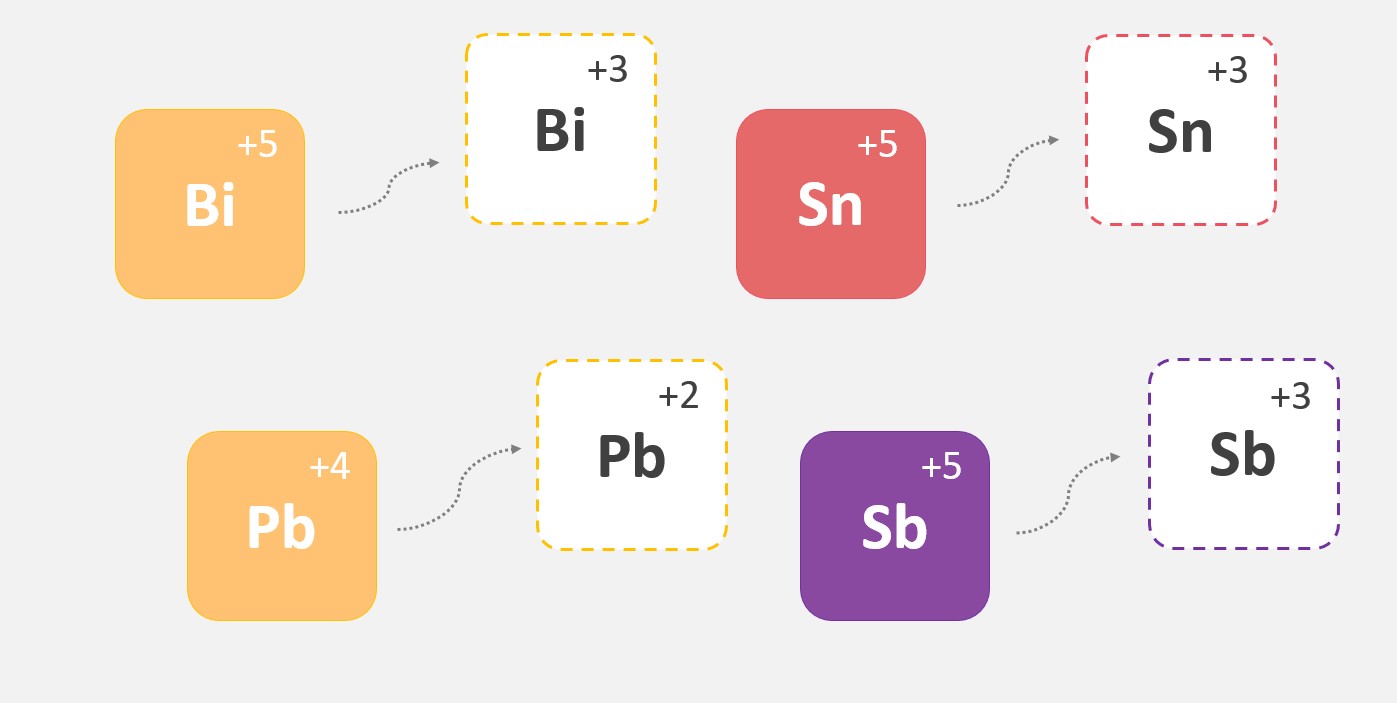
Raio iônico
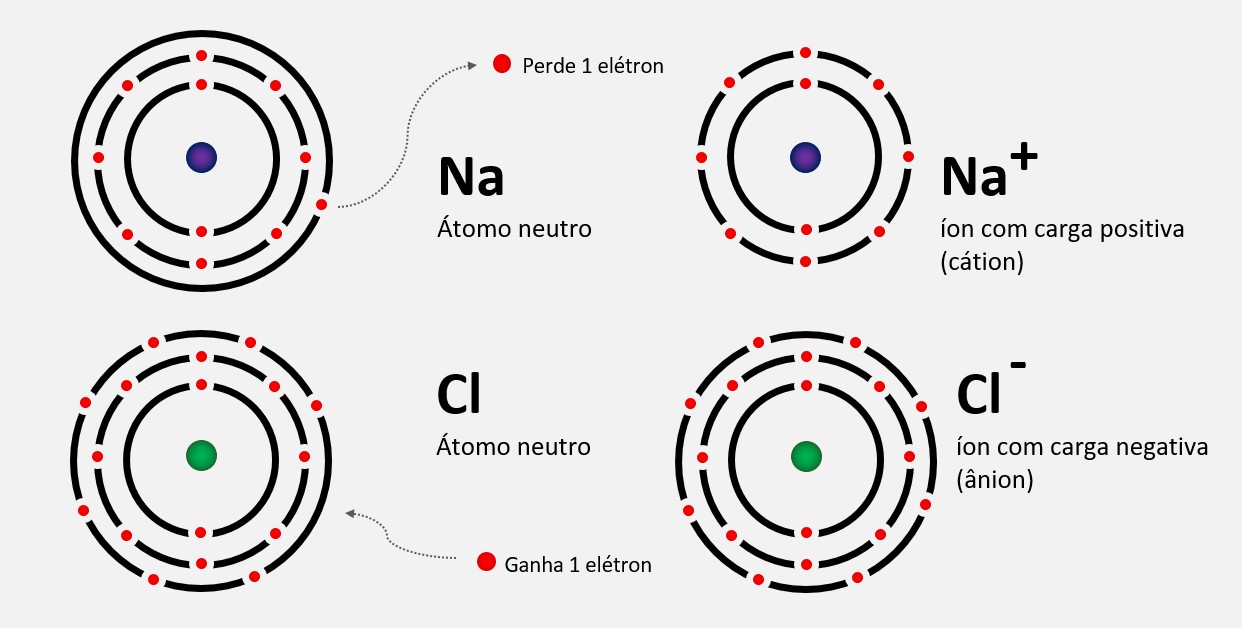
O raio iônico é uma medida do tamanho de um íon, que é uma espécie química carregada eletricamente devido à perda ou ganho de elétrons. O raio iônico é geralmente maior do que o raio atômico do mesmo elemento, uma vez que a adição ou remoção de elétrons afeta a atração entre os elétrons e os prótons no núcleo do átomo.
Raio do átomo neutro > Raio do cátion
O raio iônico de um cátion geralmente é menor do que o raio atômico do átomo original. Isso ocorre porque, quando um átomo perde elétrons para se tornar um cátion, a atração entre os elétrons restantes e o núcleo aumenta. A remoção de elétrons faz com que a nuvem eletrônica fique mais próxima do núcleo, resultando em um raio iônico menor. Quanto maior o número de elétrons removidos, menor será o raio iônico. Isso ocorre porque a carga positiva do cátion não é neutralizada por um número igual de elétrons, resultando em uma atração mais forte e, consequentemente, em um raio iônico menor.
Raio do ânion > Raio do átomo neutro
O raio iônico de um ânion é geralmente maior do que o raio atômico do átomo original. Isso acontece porque, quando um átomo ganha elétrons para se tornar um ânion, a nuvem eletrônica se expande e há um aumento na repulsão entre esses elétrons adicionais.
A adição de elétrons ao átomo faz com que a nuvem eletrônica se espalhe, resultando em um raio iônico maior. Quanto maior o número de elétrons adicionados, maior será o raio iônico. Isso ocorre porque a carga negativa adicional do ânion repulsa os elétrons, aumentando o tamanho da nuvem eletrônica e, consequentemente, o raio iônico.
Os ânions podem ser classificados de acordo com o número de cargas negativas que possuem. Aqui estão alguns exemplos:
1. Ânions monovalentes: Esses ânions possuem uma carga negativa. Exemplos incluem o cloreto (Cl-), o hidróxido (OH-), o nitrato (NO3-), o acetato (CH3COO-) etc.
2. Ânions bivalentes: Esses ânions possuem duas cargas negativas. Exemplos incluem o carbonato (CO32-), o sulfato (SO42-), o sulfeto (S2-), o oxalato (C2O42-) etc.
3. Ânions trivalentes: Esses ânions possuem três cargas negativas. Exemplos incluem o fosfato (PO43-) e o arseniato (AsO43-).
4. Ânions tetravalentes: Esses ânions possuem quatro cargas negativas. Um exemplo comum é o silicato (SiO44-).
Para o raio do ânio deve se observar o seguinte: Mesmo átomo com número de camadas iguais, observar a quantidade de número de prótons, se for a mesma quantidade, verificar a quantidade de elétrons.
O raio iônico é uma propriedade importante para entender as propriedades físicas e químicas dos compostos iônicos.