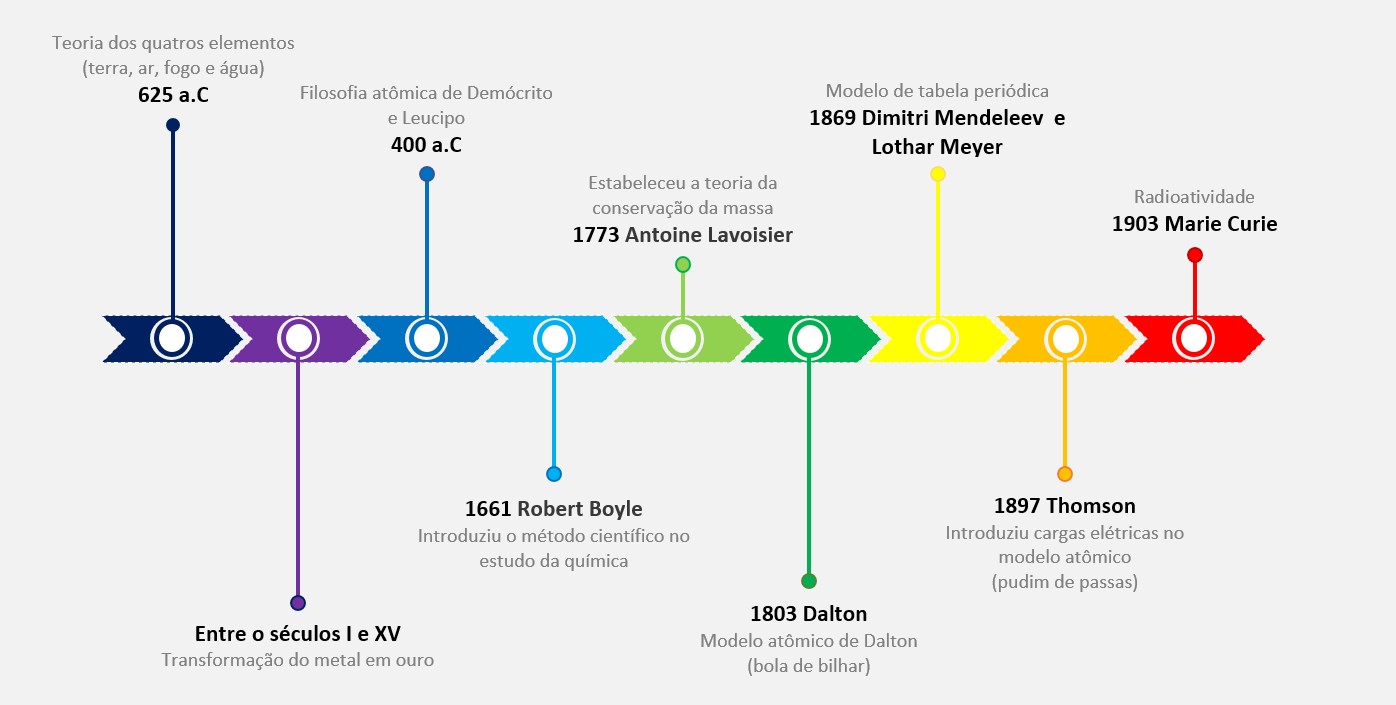
Modelo de Bohr do hidrogênio
O modelo de Bohr do hidrogênio é um modelo atômico proposto por Niels Bohr em 1913 para descrever o comportamento dos elétrons ao redor do núcleo de hidrogênio. Este modelo foi uma das primeiras tentativas de explicar as propriedades do átomo usando a teoria quântica.
O modelo de Bohr foi baseado em várias observações experimentais, incluindo o espectro de emissão discreto do hidrogênio, que consiste em linhas de emissão características. A principal ideia do modelo de Bohr é que os elétrons orbitam o núcleo em órbitas circulares discretas.
As principais características do modelo de Bohr são:
Orbitas quantizadas
Bohr propôs que apenas certas órbitas permitidas eram permitidas para os elétrons. Essas órbitas possuíam níveis de energia quantizados, onde um elétron poderia ocupar um nível específico.
Transições eletrônicas
Bohr sugeriu que a emissão ou absorção de radiação ocorria quando um elétron saltasse de uma órbita para outra com níveis de energia diferentes. Essa transição resultaria em um ganho ou perda de energia, manifestada na forma de luz.
Níveis de energia
Bohr propôs que os níveis de energia do hidrogênio eram dados por E = A / n² onde n é um número inteiro chamado de número quântico principal. Esse modelo explicou por que o espectro de emissão do hidrogênio era discreto, pois apenas certas transições eletrônicas eram permitidas entre os níveis de energia.
Embora o modelo de Bohr tenha sido uma contribuição significativa para a compreensão dos átomos, ele possui algumas limitações. Ele não fornece uma descrição completa de sistemas com mais de um elétron e não considera os princípios fundamentais da mecânica quântica. No entanto, o modelo de Bohr lançou as bases para o desenvolvimento posterior da teoria quântica.