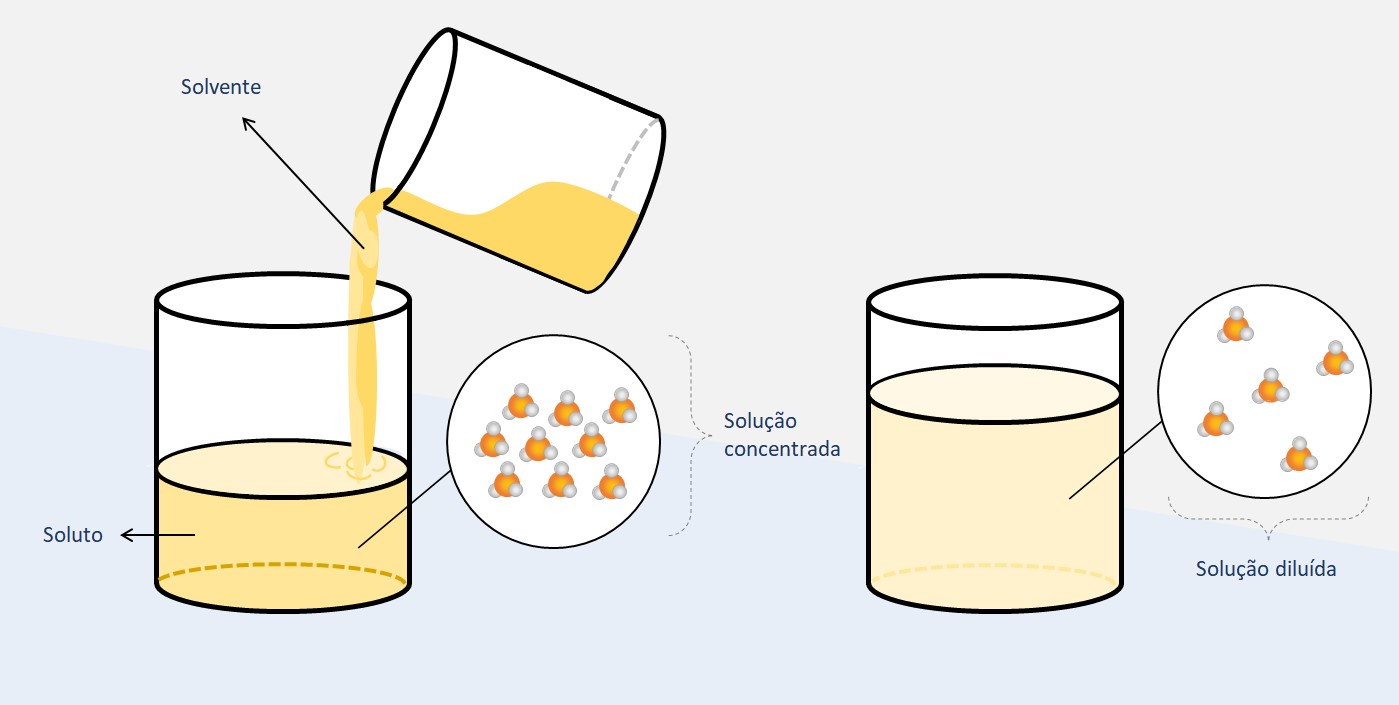
Concentração de soluções
A concentração de soluções é a medida da quantidade de soluto presente em relação ao solvente em uma determinada solução. É uma informação essencial para determinar as propriedades e comportamento das soluções. A concentração pode ser expressa de diferentes maneiras, como concentração comum, molaridade, título, partes por milhão, molalidade e relação entre as concentrações.
É uma forma de expressar a concentração de uma solução em relação à quantidade de soluto e de solvente. Ela é calculada através da relação entre a massa do soluto e o volume da solução.
A fórmula para calcular a concentração comum é a seguinte:
C = m / V
Onde:
C = concentração comum em gramas por litro (g/L)
m = massa do soluto em gramas (g)
V = volume da solução em litros (L)
Por exemplo, se temos uma solução com 50 gramas de soluto e 500 mL (ou 0,5 L) de volume, a concentração comum dessa solução será:
C = 50 g / 0,5 L = 100 g/L
Isso significa que a solução tem uma concentração de 100 gramas de soluto para cada litro de solução. A concentração comum é uma das formas mais simples e utilizadas para expressar a concentração de soluções.
Também conhecida como molaridade, é uma medida da concentração de uma solução expressa em termos do número de mols de soluto por litro de solução. É amplamente utilizada na química para descrever a quantidade de soluto presente em uma solução.
A fórmula para calcular a concentração molar é a seguinte:
M = n / V
Onde:
M = concentração molar em mol/L
n = número de mols de soluto
V = volume da solução em litros
M = m / M1.V
Onde:
M = é a molaridade (concentração molar) da solução, expressa em mol/L
m = é a massa do soluto, expressa em gramas
M1 = é a massa molar do soluto, expressa em g/mol
V = é o volume da solução, expresso em litros
Por exemplo, se temos uma solução com 0,1 mol de soluto em 1 litro de solução, a concentração molar dessa solução será:
M = 0,1 mol / 1 L = 0,1 mol/L
Isso significa que a solução tem uma concentração de 0,1 mol de soluto por litro de solução. A concentração molar é uma medida importante na química, pois permite calcular a quantidade exata de reagentes necessários em uma reação química, além de determinar o comportamento
Também conhecida como porcentagem em massa da solução, é uma forma de expressar a concentração de uma solução em relação à massa do soluto em relação à massa total da solução.
A fórmula para calcular o título de uma solução é a seguinte:
T = (m1 / m) x 100
Onde:
T = título da solução em porcentagem (%)
m1 = massa do soluto em gramas (g)
m = massa total da solução em gramas (g)
Por exemplo, se temos uma solução com 20 g de soluto e 100 g de solvente, o título dessa solução será:
T = (20 g / 120 g) x 100 = 16,7%
Isso significa que a solução tem uma concentração de 16,7% de soluto em relação à massa total da solução. A concentração em título é bastante utilizada em situações onde se deseja conhecer a quantidade de soluto em relação à massa total da solução.
É uma unidade de medida bastante utilizada para expressar a concentração de solutos ou contaminantes em soluções. Ela representa a quantidade de partículas de soluto por milhão de partículas de solução.
A fórmula para calcular a concentração em partes por milhão é a seguinte:
ppm = (número de mols de soluto / número total de mols na solução) x 1 000 000
Importante:
ppm = mg/L
Por exemplo, se temos uma solução com 0,001 mols de soluto e um total de 5 mols na solução, a concentração em partes por milhão será:
ppm = (0,001 mol / 5 mol) x 1 000 000 = 200 ppm
Isso significa que a solução tem uma concentração de 200 partes de soluto por milhão de partes de solução.
A concentração em partes por milhão é frequentemente utilizada para expressar pequenas quantidades de substâncias presentes em uma solução ou em uma matriz.
Também conhecida como concentração molal, é uma medida da concentração de uma solução em relação ao número de mols do soluto por quilograma de solvente.
Ela é expressa pela seguinte fórmula:
m = n / m2
Onde:
m = molalidade (em mol/kg)
n = número de mols do soluto
m2 = massa do solvente em quilogramas (kg)
Ao contrário da concentração molar, que é expressa em mols por litro de solução, a molalidade se refere à relação do soluto com a massa do solvente. Isso faz com que a molalidade seja uma medida mais precisa em situações em que há alterações de temperatura e a densidade da solução pode variar.
Por exemplo, se uma solução contém 0,1 mol de soluto dissolvido em 0,5 kg de solvente, a molalidade dessa solução será:
m = 0,1 mol / 0,5 kg = 0,2 mol/kg
Isso significa que a solução possui uma concentração de 0,2 mol de soluto por quilograma de solvente. A molalidade é especialmente útil quando se trabalha com solventes que sofrem alterações de volume significativas com mudanças na temperatura, como é o caso de soluções aquosas.
Pode ser exemplificada utilizando fórmulas diferentes, dependendo do contexto e dos componentes envolvidos na solução.
C = 1000 . d . T
Onde:
C = concentração da substância
d = densidade da solução
T = título da solução
A concentração (C) é calculada multiplicando a densidade (d) pela temperatura (T) e por um fator multiplicativo de 1000.