Diluição de soluções
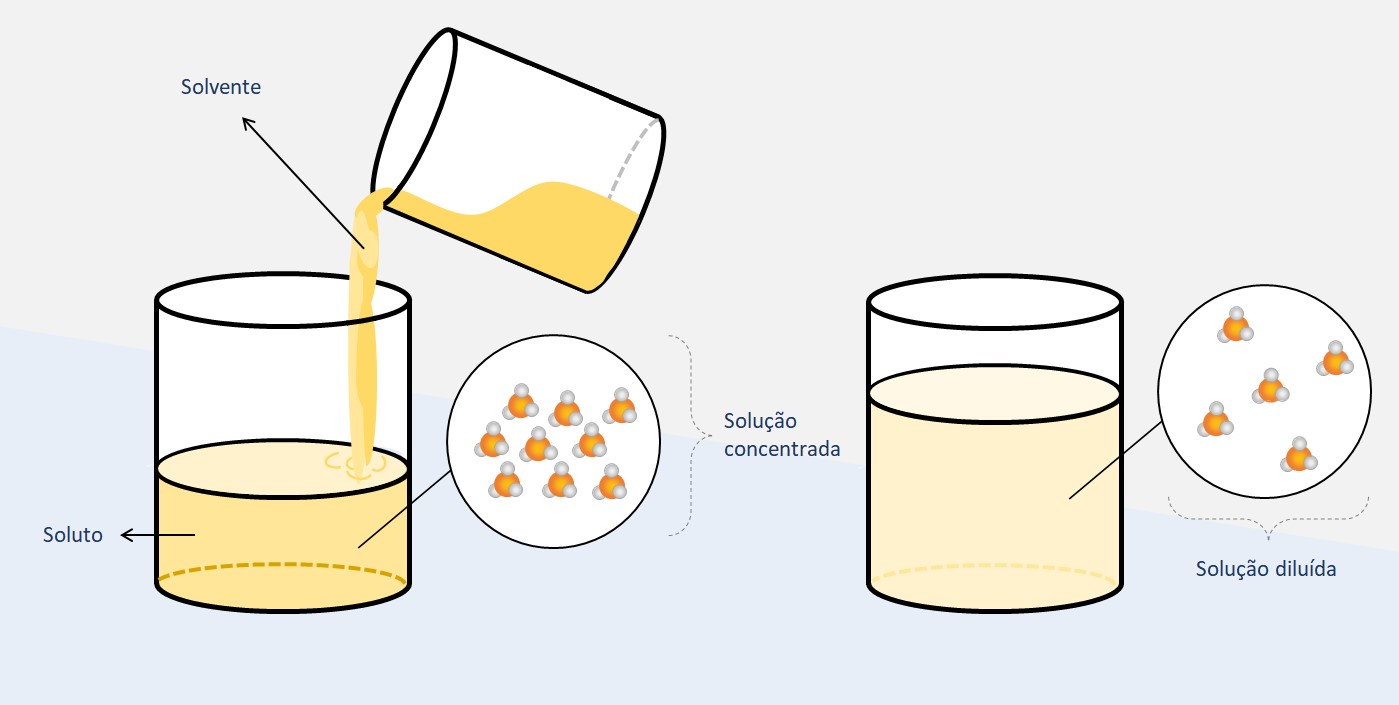
A diluição de soluções é um processo através do qual se adiciona solvente a uma solução originalmente concentrada, resultando em uma solução menos concentrada. Isso geralmente é feito para ajustar a concentração da solução para um valor desejado ou para facilitar experimentos ou cálculos.
A diluição de soluções é feita de acordo com a relação conhecida como Lei de Diluição de Ostwald, que afirma que a concentração final de uma solução diluída é diretamente proporcional à concentração inicial e inversamente proporcional ao volume total da solução.
Por exemplo, se seguirmos as instruções na embalagem de um concentrado de suco e adicionarmos 500 ml de água a um copo do concentrado, estaremos diluindo a solução concentrada para obter uma bebida mais leve e menos doce.
Nesse caso, estamos ajustando a concentração do suco a fim de torná-lo mais agradável ao paladar e adequado para consumo. Esse é um exemplo simples de diluição que fazemos no dia a dia.
Para fazer essa diluição, você poderia pipetar um volume específico, por exemplo, 10 mL, da solução concentrada de 1 mol/L e transferi-lo para um balão volumétrico de 100 mL. Em seguida, adicionaria água destilada até atingir a marca de 100 mL no balão, garantindo assim que o volume total seja exatamente 100 mL.
Dessa forma, você estará diluindo a solução inicial de 1 mol/L para obter uma nova solução de concentração conhecida de 0,1 mol/L, assim, utilizada para fins analíticos ou de calibração. É importante seguir as boas práticas de laboratório para garantir a precisão e exatidão na preparação das soluções diluídas, utilizando equipamentos com precisão adequada e realizando os cálculos necessários para obter a diluição desejada.
Existem duas fórmulas comumente utilizadas para calcular a diluição de soluções:
Onde:
C1 = concentração inicial da solução (mol/L)
V1 = volume inicial da solução (L)
C2 = concentração final desejada da solução (mol/L)
V2 = volume final desejado da solução (L)
Essa fórmula é utilizada quando se conhece a concentração e o volume inicial da solução, e deseja-se calcular o volume final necessário para obter a concentração desejada.
Onde:
C1 = concentração inicial da solução (mol/L)
V1 = volume inicial da solução (L)
C2 = concentração final da solução diluída (mol/L)
V2 = volume da solução diluída retirado da solução inicial (L)
Essa fórmula é utilizada quando se deseja preparar várias diluições consecutivas a partir de uma solução inicial. Cada diluição subsequente utiliza o volume da solução diluída anterior como volume inicial.
Na fórmula acima, é importante garantir que as concentrações estejam na mesma unidade (por exemplo, mol/L) e os volumes estejam na mesma unidade de volume (por exemplo, L).