Entalpia
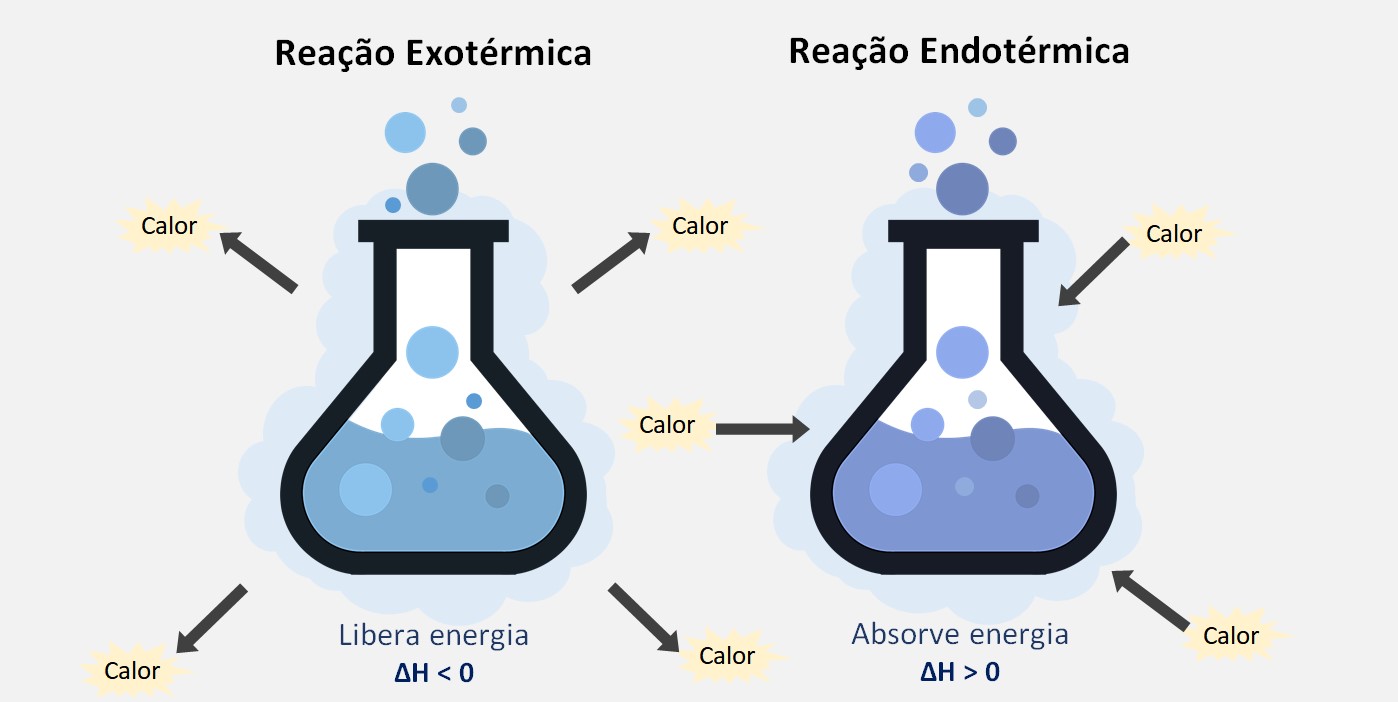
A variação da entalpia de um processo é representada pela letra ΔH. Se a quantidade de energia liberada durante a reação é maior do que a quantidade absorvida, o processo é exotérmico e a variação da entalpia é negativa (ΔH < 0). Se a quantidade de energia absorvida é maior do que a quantidade liberada, o processo é endotérmico e a variação da entalpia é positiva (ΔH > 0).
ΔH < 0 → exotérmica
ΔH > 0 → endotérmica
A quantidade de energia liberada ou absorvida durante uma reação química depende das ligações químicas que estão sendo quebradas e formadas. Quando ligações químicas são quebradas, é necessário fornecer energia para superar a força atrativa entre os átomos. Por outro lado, quando ligações químicas são formadas, energia é liberada na forma de calor, uma vez que a atração entre os átomos diminui.
As entalpias de formação, combustão e ligação são importantes para estudos termodinâmicos e são frequentemente usadas para determinar as propriedades energéticas de substâncias químicas e reações. Elas podem ser usadas para calcular a energia liberada ou absorvida em uma reação química, bem como para projetar processos de combustão e determinar a estabilidade de compostos químicos.
A entalpia também está relacionada com a Lei de Hess, que estabelece que a entalpia de uma reação química depende apenas dos estados inicial e final da reação, não importando os caminhos intermediários pelos quais a reação ocorre.
A principais entalpias são:
Exemplo: Calcule o ΔH em Kcal/mol, a 25°C para:
Dados: Fe2O3 = 196,50 Kcal/mol, CO = 26,41 Kcal/mol, FeO = 63,80 Kcal/mol, CO² = 94,05 Kcal/mol.
ΔH = ΣHproduto - ΣHreagente
ΔH = (1.(196,50) + 1.(26,41) - (2.(63,80) + 1.(94,05)
ΔH = 222,91 - (127,6 + 94,05)
ΔH = 222,91 - (127,6 + 94,05)
ΔH = 222,91 - 221,65
ΔH = 1,26 Kcal/mol (Fe2O3)
Exemplo da combustão completa de 1 mol de álcool etílico (C2H6O).
(valor de ΔH referente a 1 mol de C2H6O)
Outro exemplo:
Dados: MM: CH4= 16 g/mol.
1 CH4 + 2 O2 → CO2 + 2 H2O ΔH= -890 KJ/mol
1mol de CH4 -------------- ΔH= -890 KJ/mol
(1 mol é igual a 16 g de CH4)
16 g de CH4 ------------------ ΔH= -890 KJ/mol
80 g de CH4 ------------------ X KJ/mol
X = -4450 KJ/mol
Cálculo de Delta H:
1 N2 + 3 H2 → 2 NH3 ΔH = ?
Ligação –––––––––––– Energia de ligação
N≡N –––––––––––––––– 942 KJ/mol
H–H –––––––––––––––– 432 KJ/mol
N–H –––––––––––––––– 386 KJ/mol
ΔH = Hreagente - Hproduto
ΔH = [1 (ligação). 942 + 3 (ligação).432] - [6(ligação).386]
ΔH = [942 + 1296] - [2316]
ΔH = [2238] - [2316]
ΔH = - 78 KJ
ΔH < 0 (reação exotérmica)
Em resumo, a entalpia é uma propriedade termodinâmica da matéria que está relacionada com a energia contida nas substâncias. Ela pode ser medida através da variação da entalpia (ΔH) de um processo, que corresponde à quantidade de energia liberada ou absorvida durante a reação.
Essa expressão representa a diferença entre as entalpias dos produtos e dos reagentes de uma reação química. A variação da entalpia (ΔH) indica a quantidade de energia liberada ou absorvida durante a reação. Se ΔH for negativo, significa que a reação é exotérmica, ou seja, libera energia na forma de calor. Se ΔH for positivo, significa que a reação é endotérmica, ou seja, absorve energia na forma de calor.
É importante ressaltar que os valores de entalpia não podem ser medidos diretamente, apenas as variações de entalpia (ΔH) podem ser calculadas ou determinadas experimentalmente.