Variação da entalpia (ΔH)
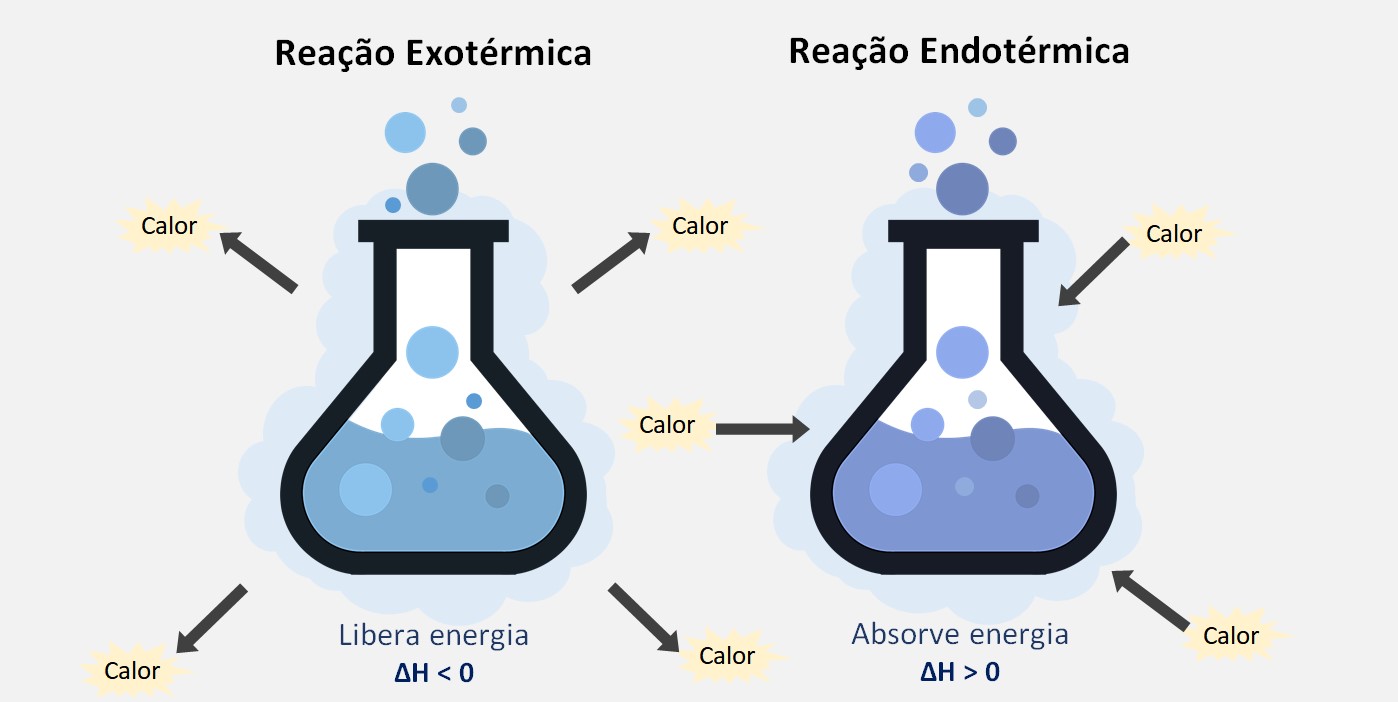
Reações endotérmicas (entra calor)
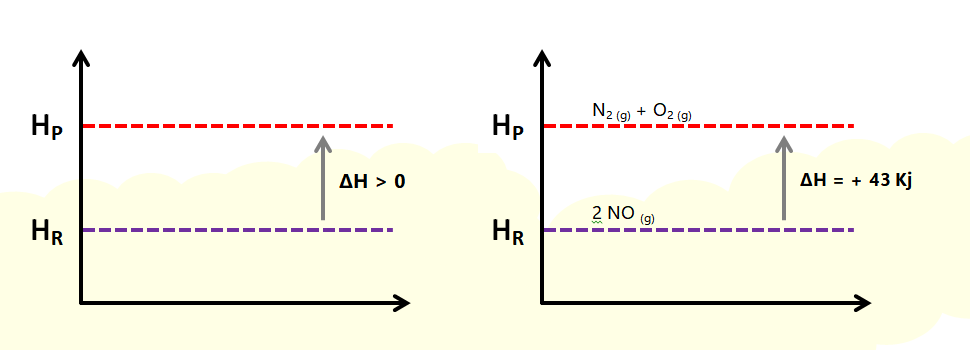
Nas reações endotérmicas, ocorre absorção de calor pelo sistema, resultando em um aumento da entalpia dos produtos em relação aos reagentes. Isso é refletido em uma variação positiva da entalpia (ΔH>0), indicando que a energia é absorvida do ambiente.
Um exemplo clássico é a decomposição térmica do bicarbonato de sódio, representada pela equação:
N2 (g) + O2 (g) → 2 NO (g) ΔH = + 43 Kj
Ou
N2 (g) + O2 (g) + 43 Kj → 2 NO (g)
A variação de entalpia (ΔH) em uma reação química é calculada subtraindo a entalpia dos reagentes (Hreagente) da entalpia dos produtos (Hproduto). Portanto, a fórmula para calcular ΔH é:
ΔH = Hproduto − Hreagente
ΔH > 0
Graficamente temos:
Reações exotérmicas (expulsa calor)
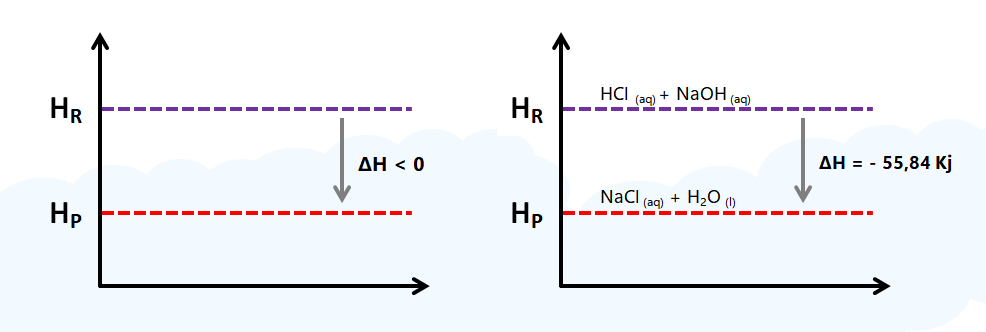
Por outro lado, nas reações exotérmicas, ocorre liberação de calor para o ambiente, resultando em um decréscimo da entalpia dos produtos em relação aos reagentes. Isso é refletido em uma variação negativa da entalpia (ΔH<0), indicando que a energia é liberada durante o processo. Um exemplo é a combustão do metano:
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l) ΔH: - 55,84 kJ
Ou
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l) + 55,84 kJ
Nas reações exotérmicas, devido à liberação de calor, a entalpia dos produtos (HP) é inferior à entalpia dos reagentes (HR).
ΔH = Hproduto − Hreagente
ΔH < 0
Graficamente temos: