Reações de simples troca ou deslocamento
Reações de simples troca, também conhecidas como reações de deslocamento, são reações químicas em que um elemento substitui outro em um composto. Nesse tipo de reação, um elemento desloca ou troca de posição com outro elemento em um composto, resultando na formação de um novo composto.
Nas reações de deslocamento simples, um elemento desloca outro elemento de um composto. A regra geral para essas reações é que um elemento mais reativo substitui um elemento menos reativo em uma substância.
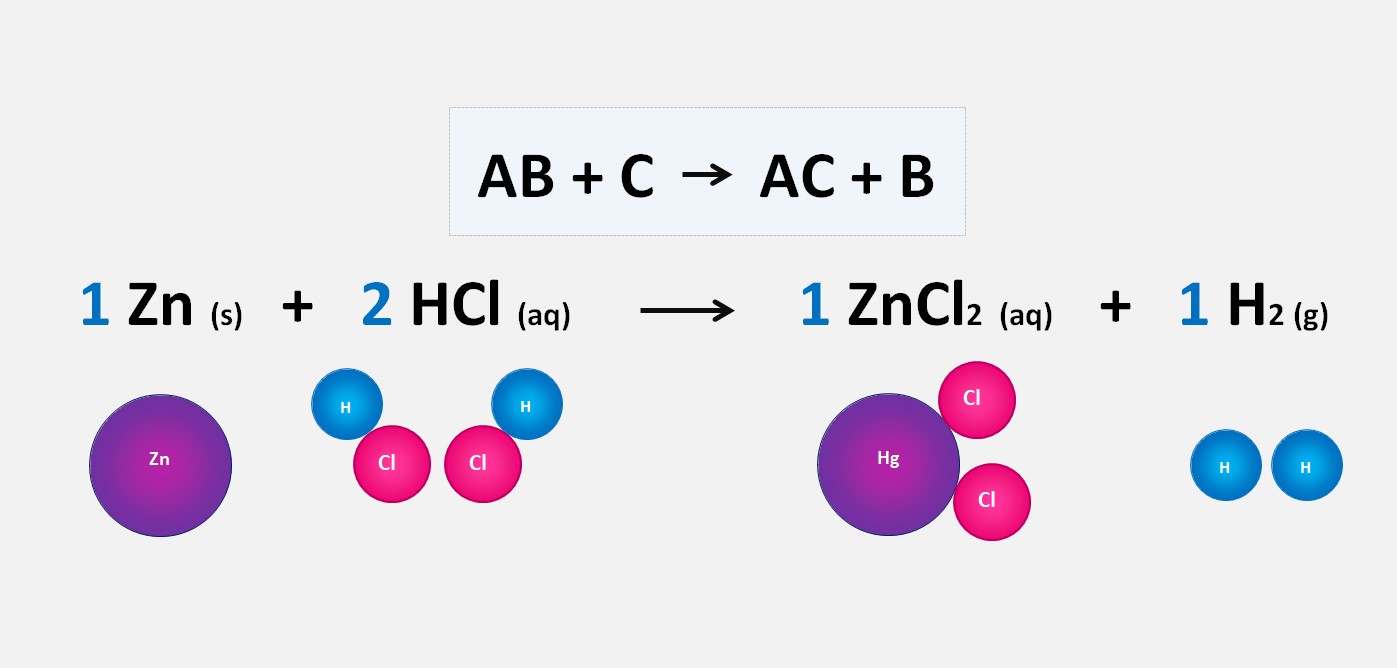
Nessa reação, o zinco (Zn) reage com o ácido clorídrico (HCl), deslocando o hidrogênio (H) do ácido para formar cloreto de zinco (ZnCl2) e hidrogênio gasoso (H2).
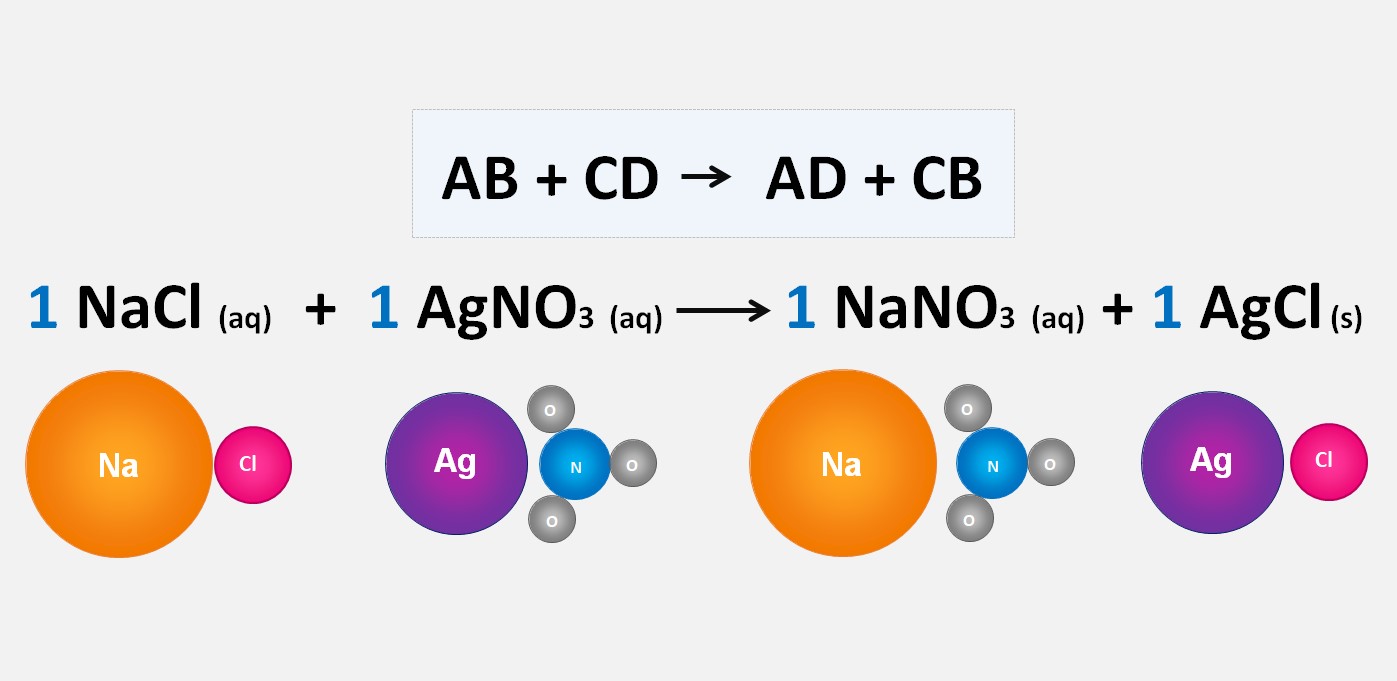
Nas reações de deslocamento duplo, dois elementos deslocam outros elementos em um composto. Um exemplo comum é a reação entre um metal e um sal.
Nessa reação, o cobre (Cu) desloca o prata (Ag) do nitrato de prata (AgNO3), resultando na formação de nitrato de cobre (Cu(NO3)2) e prata sólida (Ag).
Essas reações de simples troca ou deslocamento são importantes para entender as reatividades dos elementos e também têm várias aplicações práticas. Por exemplo, a galvanização de metais é baseada em reações de deslocamento, onde um metal mais reativo é depositado em um metal menos reativo para protegê-lo da corrosão.