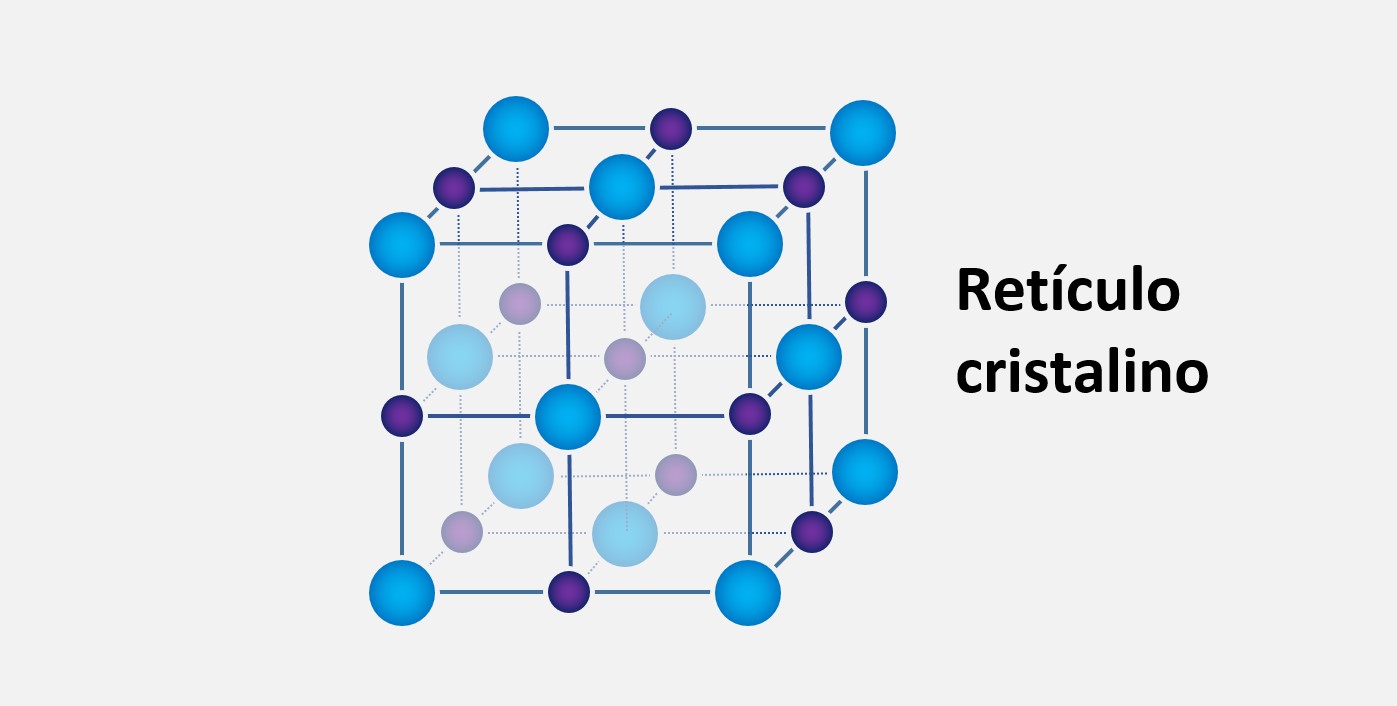
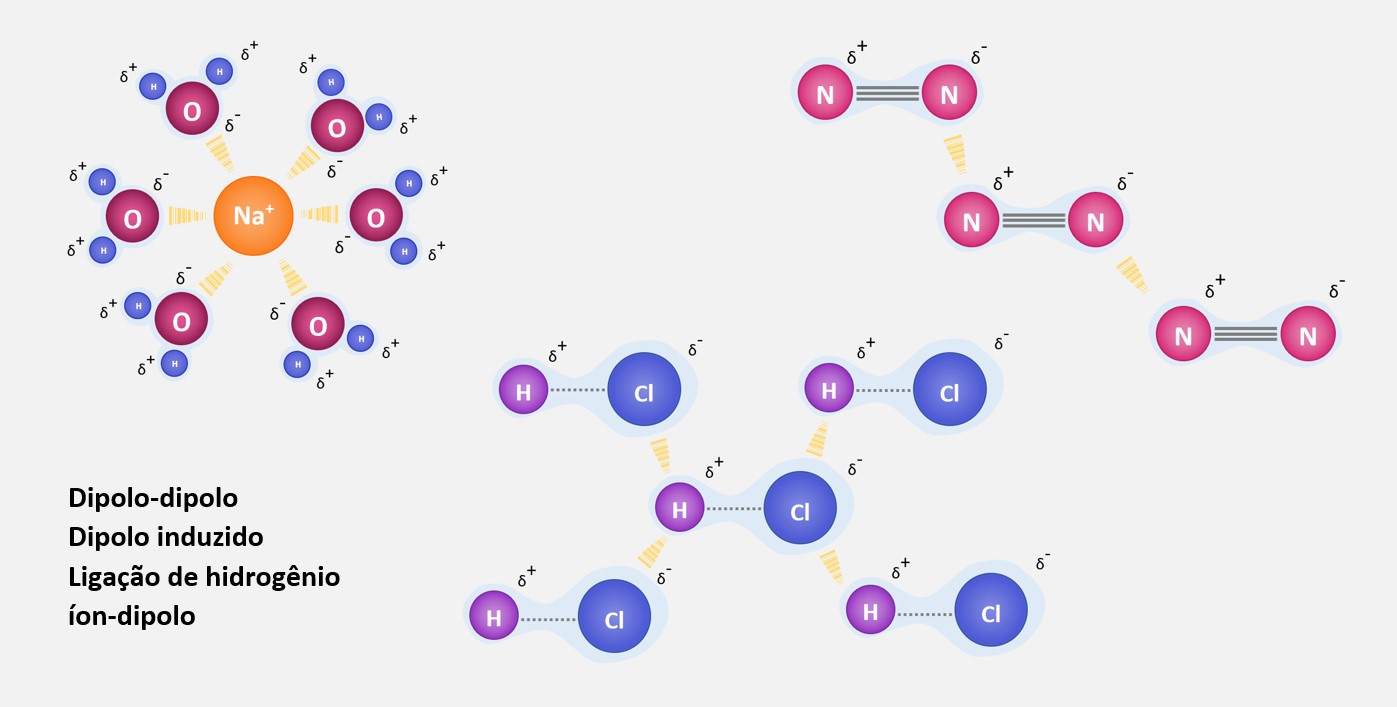
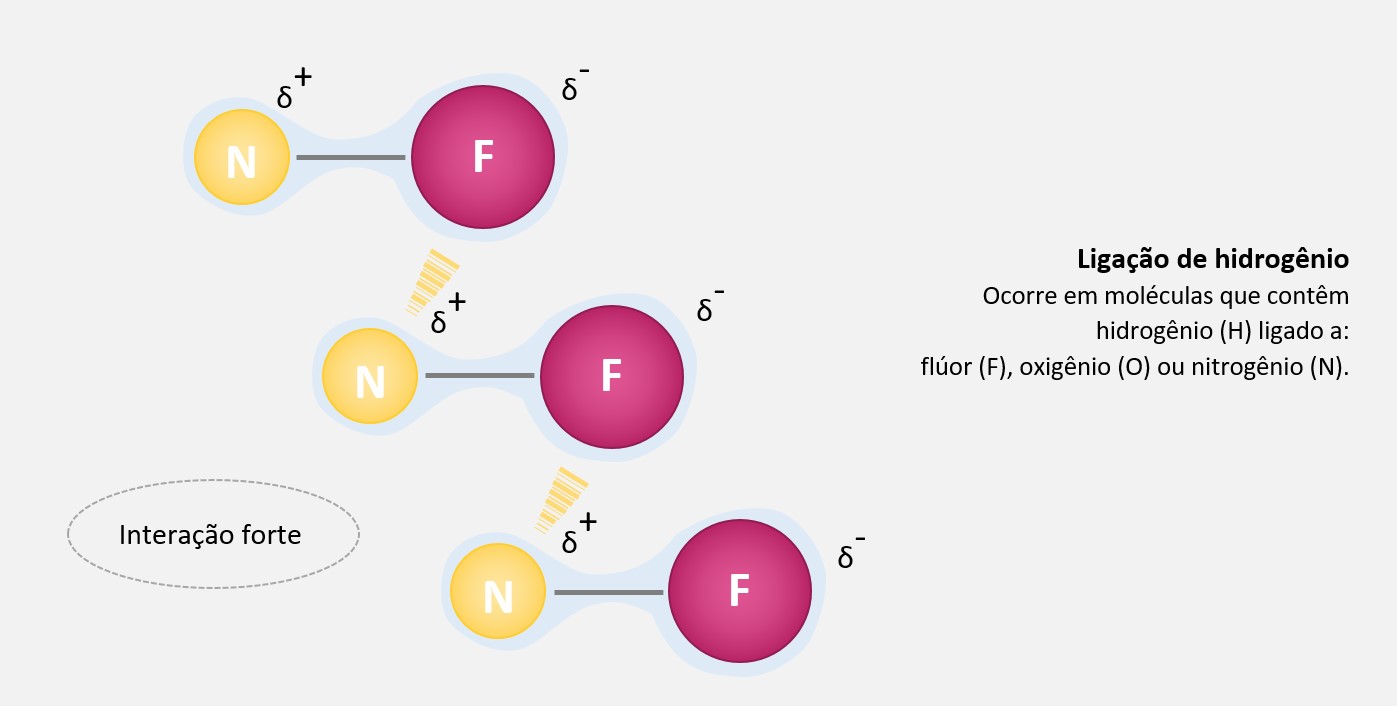
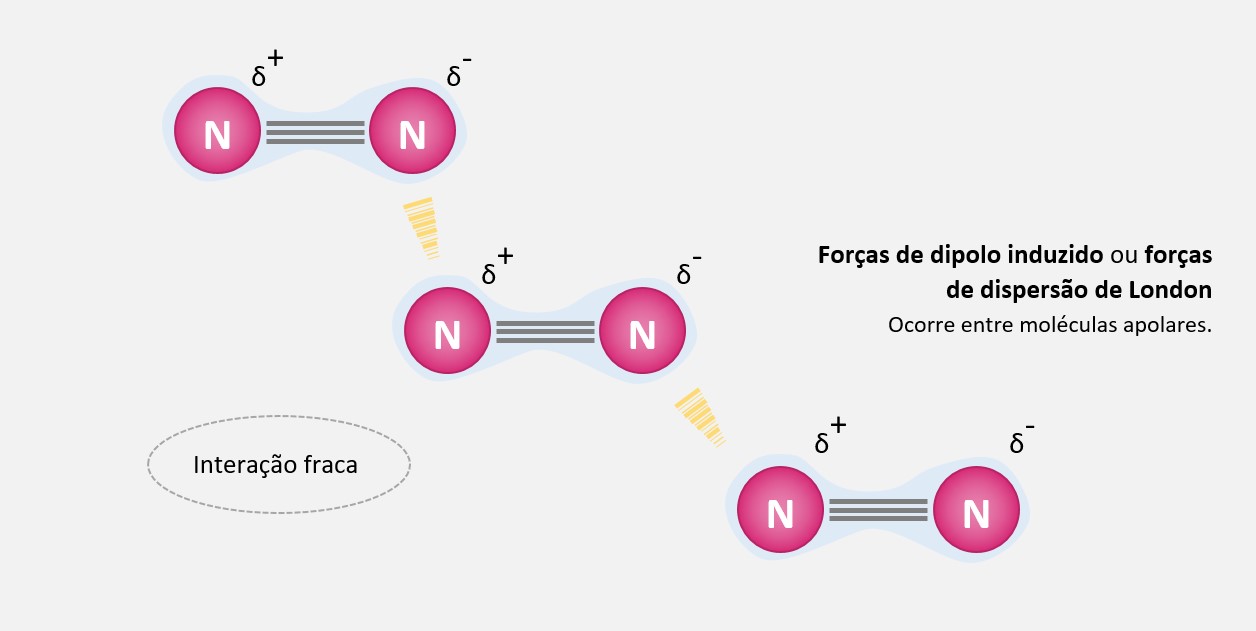
Forças de dipolo-dipolo
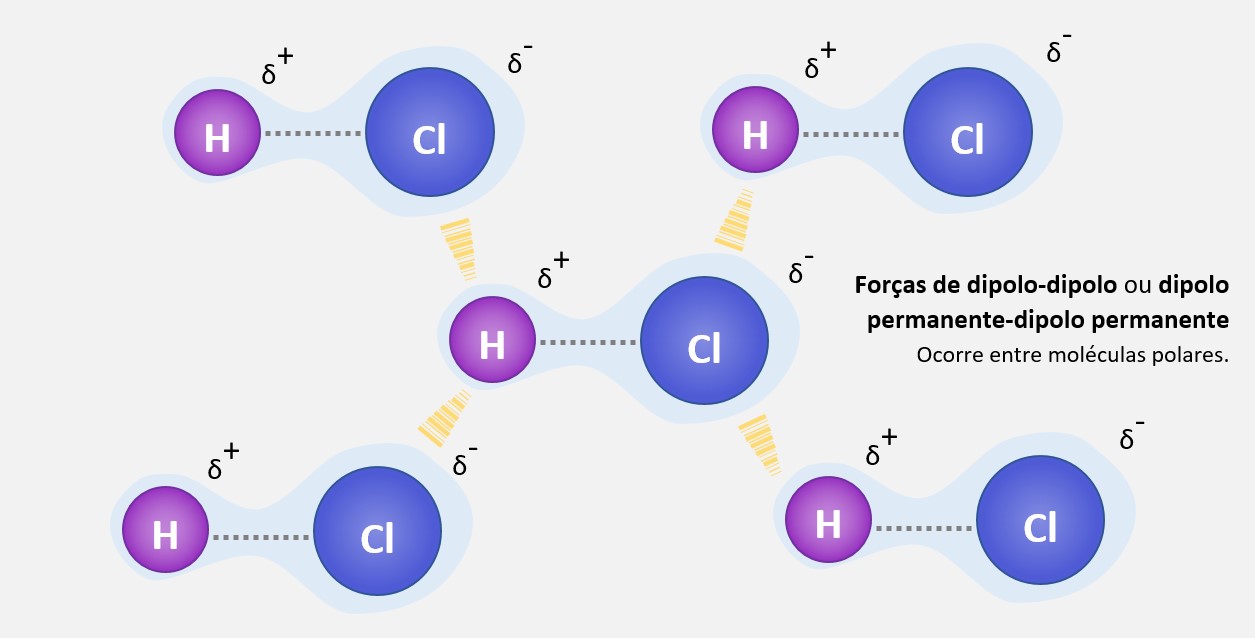
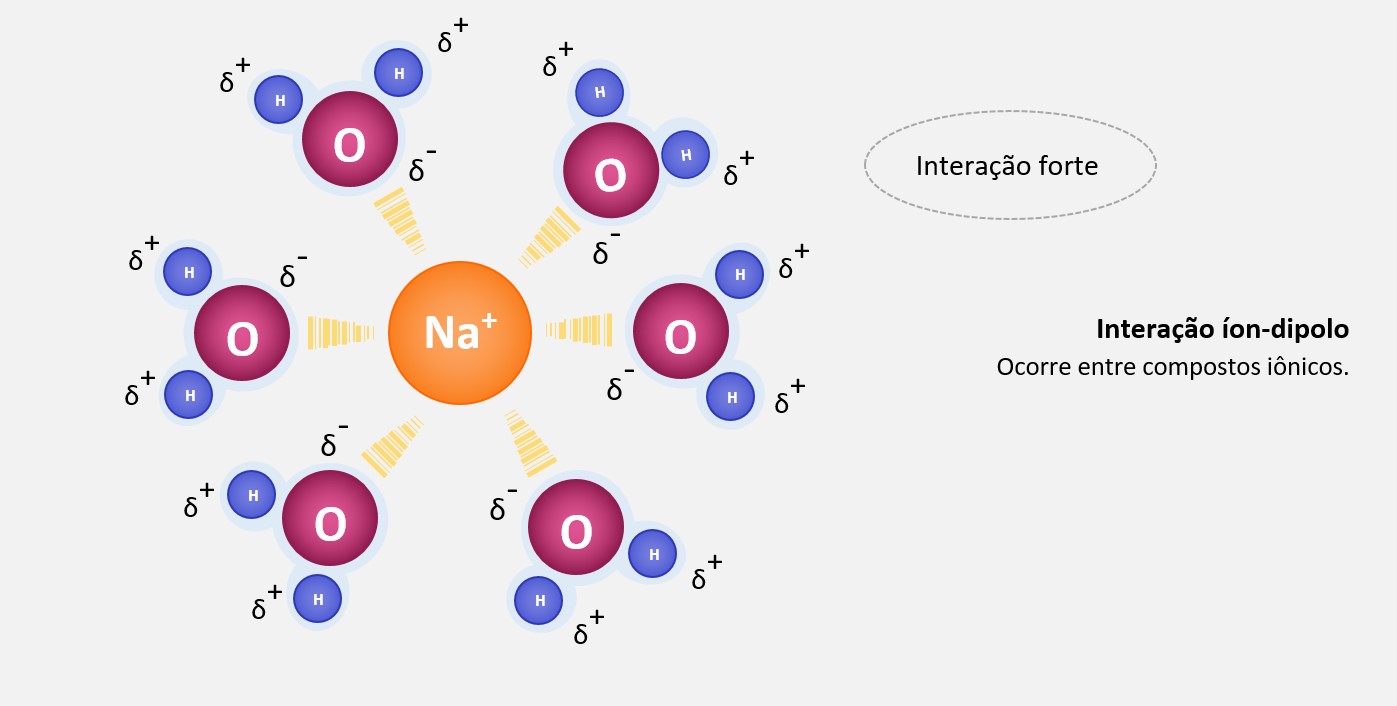
As forças de dipolo-dipolo, também conhecidas como forças de dipolo permanente-dipolo permanente, são forças intermoleculares que ocorrem entre moléculas polares. Essas moléculas têm um dipolo elétrico, ou seja, possuem uma distribuição desigual de cargas, resultando em uma região parcialmente positiva e uma região parcialmente negativa.
Essas forças ocorrem quando a região parcialmente positiva de uma molécula interage com a região parcialmente negativa de outra molécula próxima. Essa interação eletrostática é responsável por manter as moléculas polares unidas e é mais forte quanto maior for o momento de dipolo das moléculas.
Além disso, as forças de dipolo-dipolo também contribuem para outras propriedades como a solubilidade, a viscosidade e a condutividade elétrica de substâncias polares.
Um exemplo clássico de molécula polar é a do HCl (ácido clorídrico), onde o átomo de cloro atrai mais fortemente os elétrons do que o átomo de hidrogênio, resultando em uma região parcialmente negativa no cloro e uma região parcialmente positiva no hidrogênio. Quando duas moléculas de HCl se aproximam, ocorrem forças de atração entre a região parcialmente negativa de uma molécula com a região parcialmente positiva da outra molécula, formando assim as forças de dipolo-dipolo.