Eletroquímica
A eletroquímica é a área da química que estuda as reações químicas que envolvem transferência de elétrons e a conversão de energia química em energia elétrica, ou vice-versa.
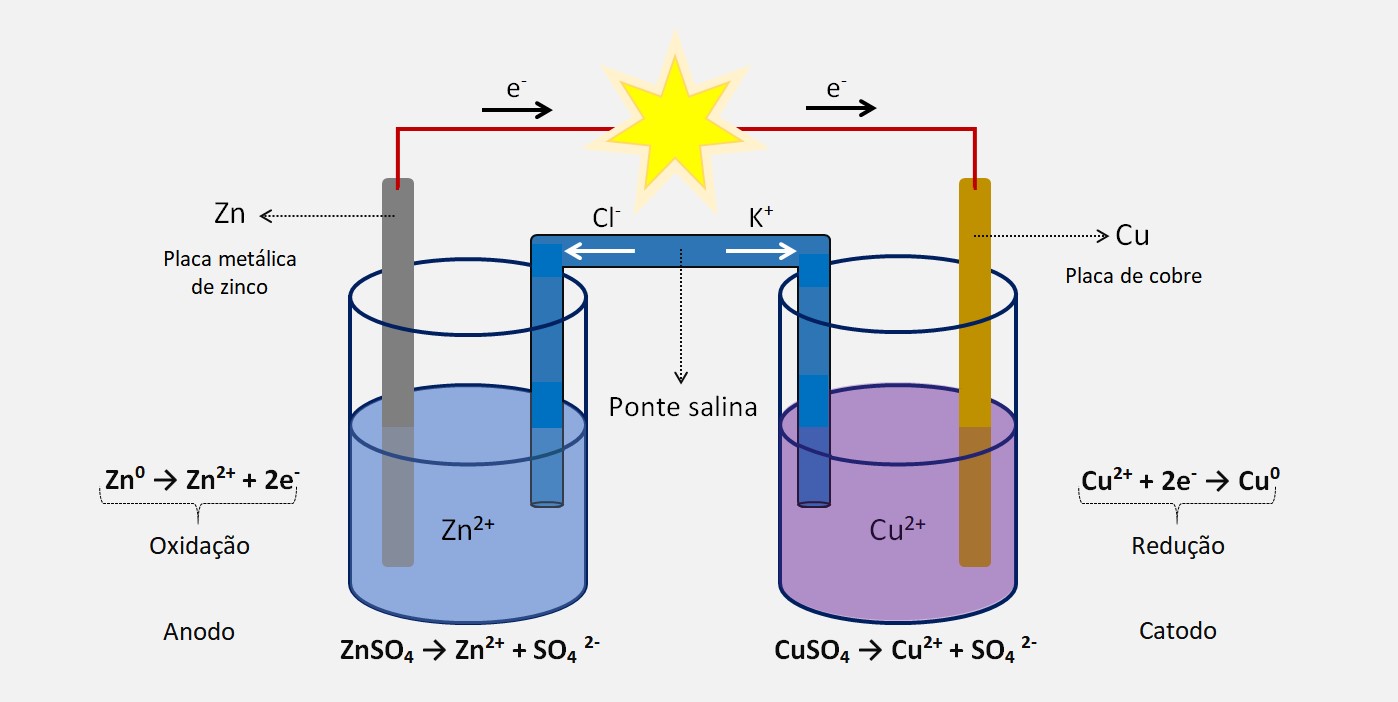
Em uma reação de oxirredução, ocorre a transferência de elétrons entre diferentes espécies químicas, conhecidas como agente oxidante e agente redutor. O agente oxidante é aquele que recebe elétrons, enquanto o agente redutor é aquele que fornece elétrons.
Na eletroquímica, essas reações ocorrem em células eletroquímicas, que são dispositivos que utilizam uma diferença de potencial elétrico (voltagem) para promover a transferência de elétrons entre dois eletrodos, através de um meio condutor. Essa transferência de elétrons gera uma corrente elétrica que pode ser utilizada para realizar trabalho útil, como acionar motores elétricos, alimentar dispositivos eletrônico, etc.
Existem dois tipos de células eletroquímicas: as células galvânicas e as células eletrolíticas.
O agente oxidante é a espécie química que provoca a oxidação, pois ela aceita os elétrons que estão sendo perdidos pela espécie oxidada. Essa espécie é reduzida durante o processo.
Já o agente redutor é a espécie química que provoca a redução, pois ela fornece os elétrons que estão sendo ganhos pela espécie reduzida. Essa espécie é oxidada durante o processo.