Ligações iônicas ou eletrovalente
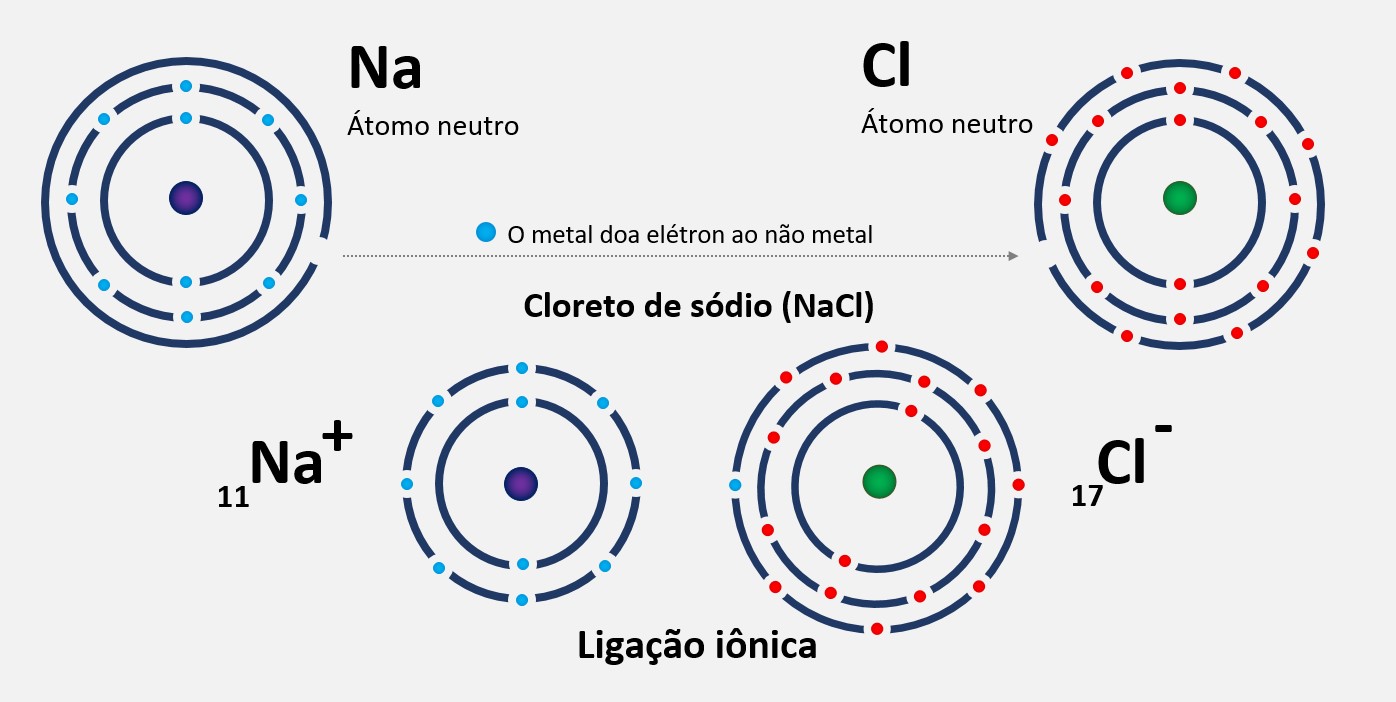
A ligação iônica ou eletrovalente é um tipo de ligação química que ocorre entre íons positivos e íons negativos. Nesse tipo de ligação, os átomos trocam elétrons para formar íons carregados opostamente. Os átomos que perdem elétrons se tornam os cátions (+), enquanto os átomos que ganham elétrons se tornam os ânions (-). Esses íons com cargas opostas atraem-se mutuamente e formam uma ligação iônica forte.
A ligação iônica é um tipo de ligação química entre átomos que ocorre através da transferência de elétrons. Ela ocorre entre um metal, que tende a perder elétrons e formar íons positivos, e um não-metal, que tende a ganhar elétrons e formar íons negativos. Na ligação iônica, os átomos se unem para formar uma estrutura chamada de retículo cristalino, que consiste em uma rede tridimensional de íons positivos e negativos. Essa ligação é caracterizada por uma forte atração eletrostática entre os íons opostamente carregados.
Um exemplo comum de ligação iônica é a formação do sal de cozinha, cloreto de sódio (NaCl). Nesse caso, o sódio (Na) perde um elétron para se tornar um cátion positivo (Na+) e o cloro (Cl) ganha esse elétron para se tornar um ânion negativo (Cl-). Os íons Na+ e Cl- se atraem e formam a ligação iônica do cloreto de sódio.
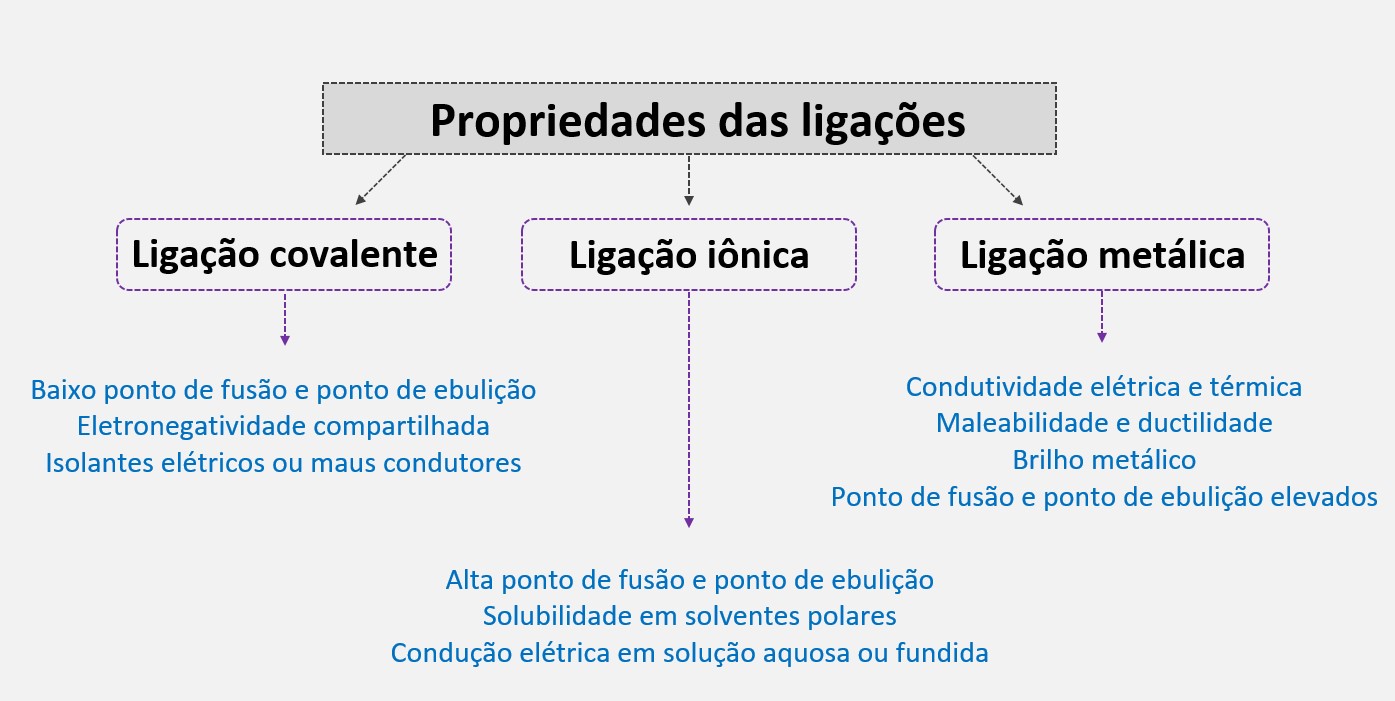
A ligação iônica é geralmente muito forte e resulta em compostos sólidos com altos pontos de fusão e ebulição. Essa ligação também é responsável pelas propriedades típicas dos compostos iônicos, como solubilidade em água, condutividade elétrica quando em solução aquosa e alta dureza.
Em resumo, a ligação iônica ocorre quando há transferência de elétrons entre um metal e um não-metal, resultando na formação de íons positivos e negativos que se atraem e formam um composto iônico.
Os elementos das famílias 1, 2 e 13 da tabela periódica (metais alcalinos, metais alcalino-terrosos e metais do grupo 13, respectivamente) tendem a perder elétrons das suas camadas de valência no processo de ligação iônica.
Os elementos da família 1 têm apenas 1 elétron na camada de valência, enquanto os da família 2 têm 2 elétrons na camada de valência e os da família 13 têm 3 elétrons na camada de valência. A perda desses elétrons resulta na formação de íons positivos, conhecidos como cátions.
Essa tendência de perda de elétrons ocorre devido à baixa energia de ionização desses metais, ou seja, é relativamente fácil para eles perderem elétrons. Por isso, esses elementos são chamados de metais eletropositivos, pois têm uma alta tendência em formar íons positivos.
Os elementos das famílias 15, 16 e 17 da tabela periódica (ametais) tendem a receber elétrons nas suas camadas de valência para alcançar uma configuração eletrônica estável com 8 elétrons na camada de valência, conhecida como regra do octeto.
Os elementos da família 15 têm 5 elétrons na camada de valência e tendem a receber 3 elétrons para ficar com 8 elétrons na camada de valência. Isso resulta na formação de íons negativos, conhecidos como ânions.
Os elementos da família 16 têm 6 elétrons na camada de valência e tendem a receber 2 elétrons para alcançar a configuração estável com 8 elétrons na camada de valência.
Os elementos da família 17 têm 7 elétrons na camada de valência e tendem a receber 1 elétron para alcançar a configuração estável com 8 elétrons na camada de valência.
Essa tendência de receber elétrons ocorre devido à alta eletronegatividade desses elementos ametais, ou seja, eles têm uma alta atração por elétrons. Por isso, esses elementos tendem a ganhar elétrons na formação de ligações iônicas ou covalentes para alcançar uma configuração eletrônica estável.