Massa atômica (u)
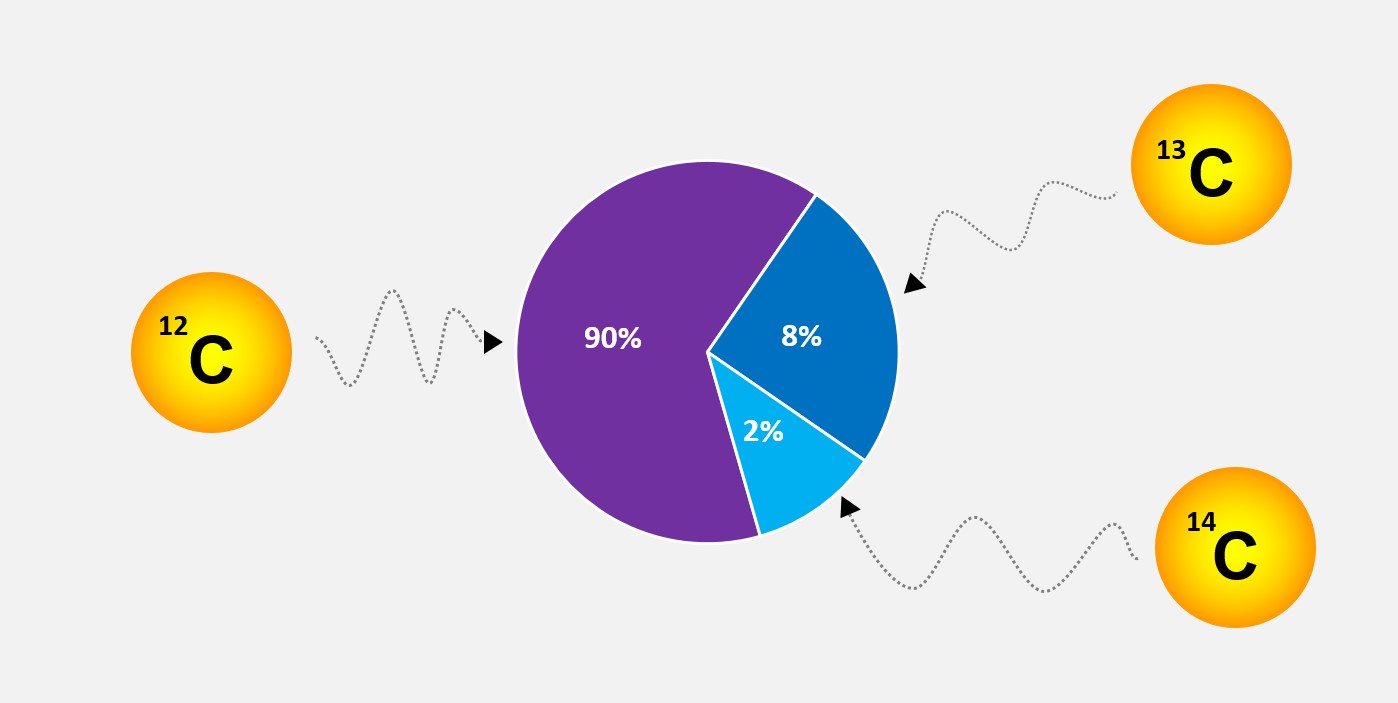
A massa atômica é a medida da massa média de um átomo em uma escala relativa, comparada à massa de um átomo de carbono-12. Ela é expressa em Unidades de Massa Atômica (u) e é determinada levando em consideração a abundância dos diferentes isótopos de um elemento na natureza.
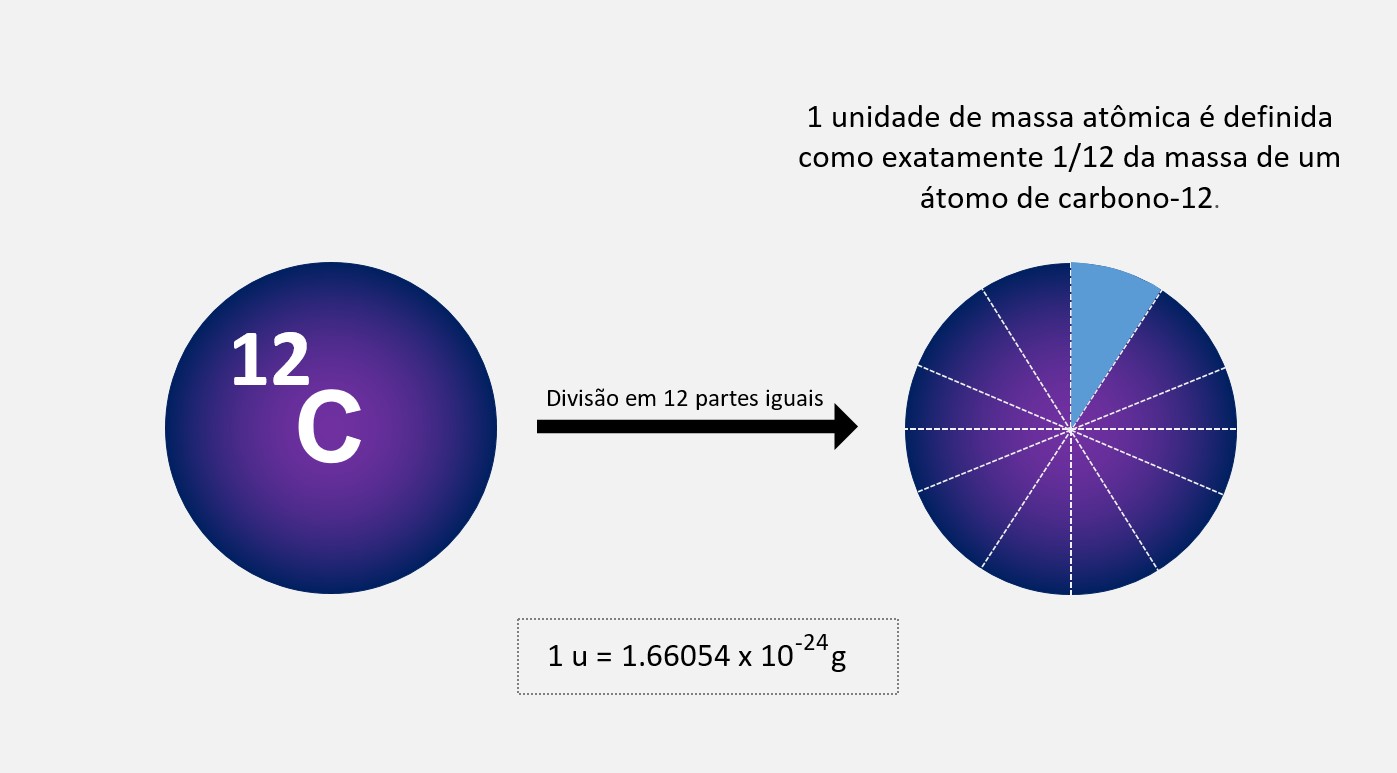
Portanto, a unidade de massa atômica (u) é a massa exata do átomo de carbono-12, que é igual a 12 unidades de massa atômica. Essa massa é atribuída ao carbono-12 por convenção, e todas as outras massas atômicas são medidas em relação a essa escala.
A massa atômica é expressa em u, e 1 unidade de massa atômica é definida como exatamente 1/12 da massa de um átomo de carbono-12. A relação entre a unidade de massa atômica (u) e a massa em gramas é aproximadamente 1 u = 1.66054 x 10^-24 g. Essa relação é fundamental para converter a massa atômica em gramas e vice-versa.
Dessa forma, a unidade de massa atômica (u) é utilizada globalmente como uma unidade padrão para expressar a massa dos átomos e das moléculas.
Por exemplo, vamos calcular a massa atômica média do elemento cloro (Cl):
1. Abundância relativa: O cloro tem dois isótopos principais, cloro-35 e cloro-37. A abundância relativa do cloro-35 é de cerca de 75% e a do cloro-37 é de cerca de 25%.
2. Massa e multiplicação: O cloro-35 tem uma massa de 35 unidades de massa atômica (u) e o cloro-37 tem uma massa de 37 u. Multiplicamos a massa de cada isótopo pela sua abundância relativa:
(35 u × 0,75) + (37 u × 0,25) = 26,25 u + 9,25 u = 35,5 u.
Portanto, a massa atômica média do cloro é de 35,5 unidades de massa atômica (u).
Aqui estão alguns exemplos de massas atômicas de elementos selecionados, expressas em unidades de massa atômica (u):
- Hidrogênio (H): 1,00784 u
- Oxigênio (O): 15,999 u
- Nitrogênio (N): 14,00674 u
- Cloro (Cl): 35,453 u
- Alumínio (Al): 26,98154 u
- Ferro (Fe): 55,845 u
- Ouro (Au): 196,96657 u
Essas massas atômicas são baseadas nos isótopos naturais desses elementos e suas respectivas abundâncias. Lembre-se de que esses valores podem variar ligeiramente dependendo das fontes utilizadas.