O que é dissociação iônica?
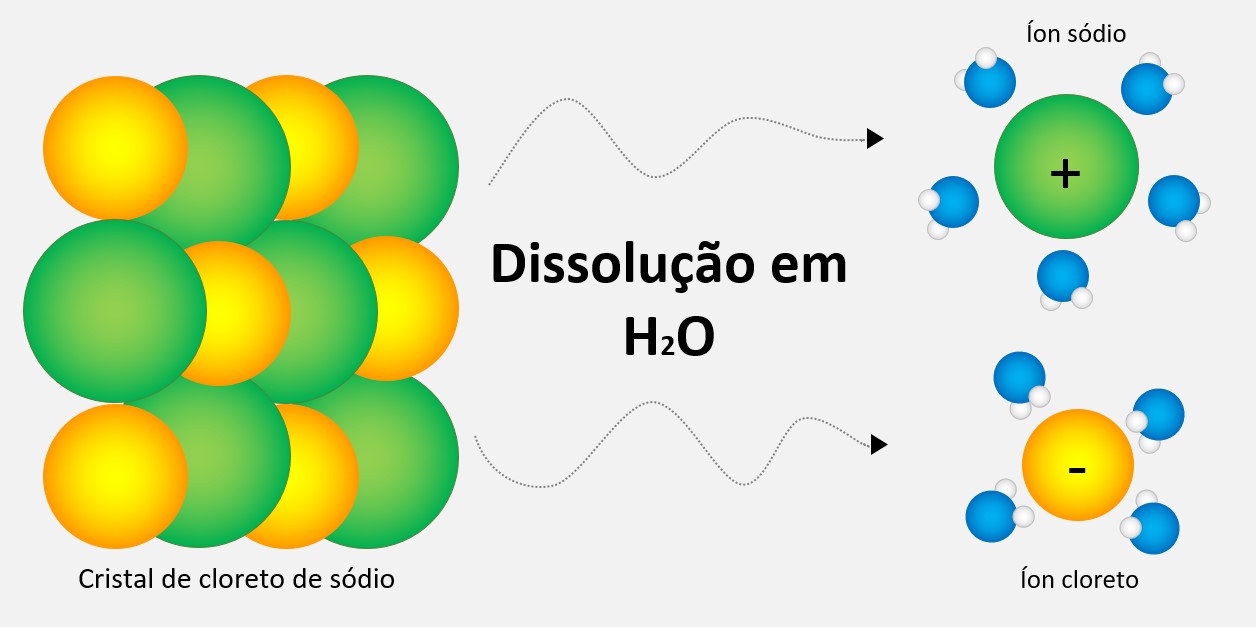
Dissociação iônica é o processo no qual um composto iônico se separa em íons quando está em solução aquosa. Essa separação ocorre devido à atração entre os íons do composto e as moléculas de água, que são polares. Durante a dissociação, os íons são livres para se mover na solução e conduzir eletricidade. Esse processo é fundamental para entender a condutividade de eletrólitos em solução.
Quando a substância se dissolve na água, as moléculas desse solvente polares atraem os íons do composto iônico. Essa interação entre os íons e as moléculas de água é chamada de solvatação ou hidratação.
Durante a solvatação, as moléculas de água rodeiam os íons, interagindo com eles por meio de atração eletrostática. As extremidades positivas das moléculas de água se ligam aos ânions, enquanto as extremidades negativas se ligam aos cátions.
Essa interação entre os íons e as moléculas de água é tão forte que supera a atração entre os próprios íons do composto iônico. Consequentemente, o composto iônico se separa em íons, tornando-se dissociado na solução.
Os íons liberados ficam solvacionados, ou seja, rodeados pelas moléculas do solvente, que continuam a interagir com eles. Essa solvatação dos íons na solução é o que permite a condução de eletricidade, uma vez que os íons carregados podem se mover livremente na solução.
Vale ressaltar que nem todos os compostos iônicos se dissolvem completamente ou se dissociam totalmente em íons em solução aquosa. Alguns podem ter uma menor taxa de dissociação iônica, formando soluções parcialmente ionizadas.
Existem vários exemplos de dissociação iônica em solução aquosa. Alguns exemplos são:
1. Cloreto de sódio (NaCl):
NaCl (s) ⇌ Na+ (aq) + Cl- (aq)
2. Sulfato de cálcio (CaSO₄):
CaSO₄ (s) ⇌ Ca²⁺ (aq) + SO₄²⁻ (aq)
3. Nitrato de potássio (KNO₃):
KNO₃ (s) ⇌ K⁺ (aq) + NO₃⁻ (aq)
4. Hidróxido de sódio (NaOH):
NaOH (s) ⇌ Na⁺ (aq) + OH⁻ (aq)
5. Carbonato de cálcio (CaCO₃):
CaCO₃ (s) ⇌ Ca²⁺ (aq) + CO₃²⁻ (aq)
Nesses exemplos, o composto iônico se dissolve em água e se dissocia em seus respectivos íons, que ficam solvacionados na solução aquosa, prontos para conduzir corrente elétrica.
