Estudo das propriedades físicas e químicas
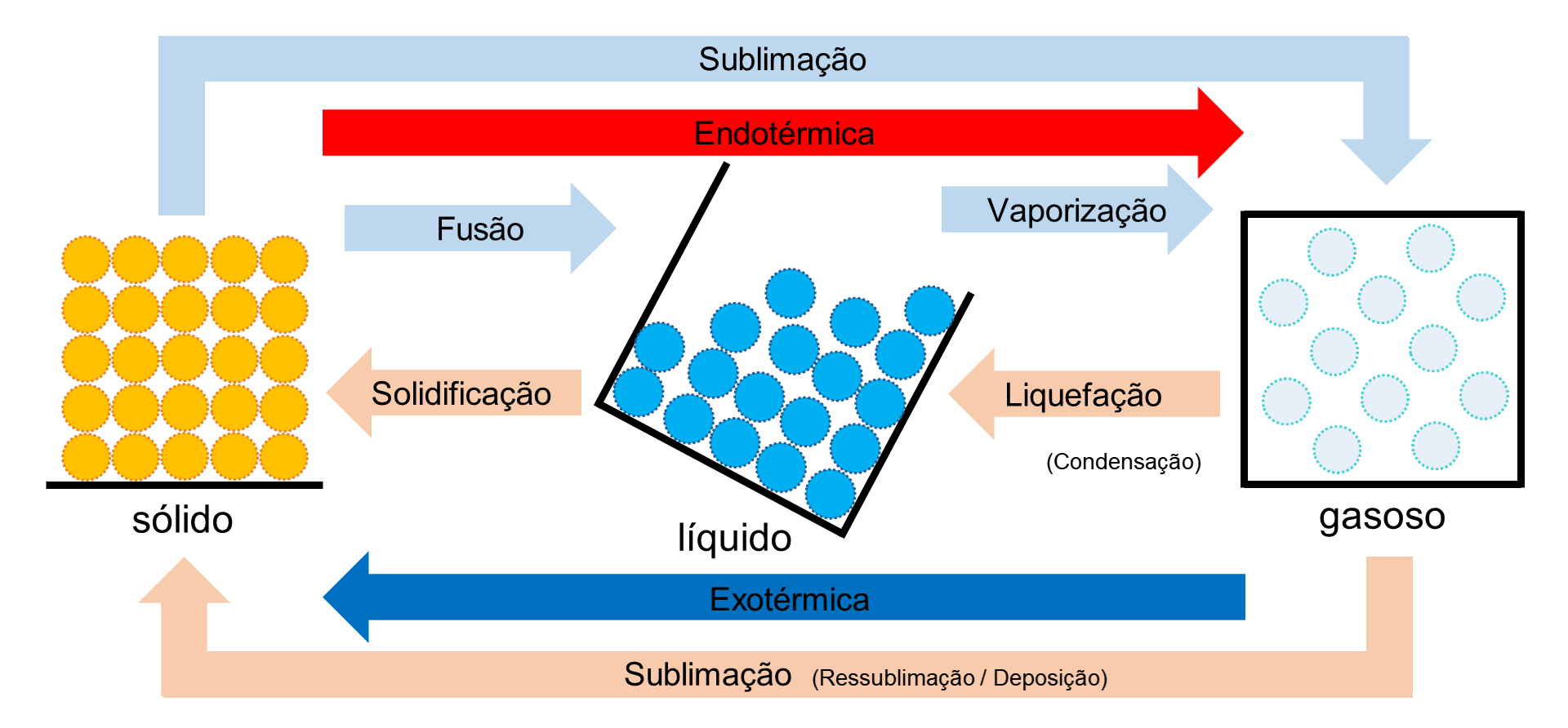
O estudo das propriedades físicas e químicas é fundamental na química e envolve a análise das características de substâncias.
Propriedades físicas referem-se a características observáveis ou mensuráveis que não alteram a composição química da substância, como cor, densidade, ponto de fusão, ponto de ebulição e solubilidade. Esses atributos ajudam a identificar e classificar materiais.
Propriedades químicas, por outro lado, são relacionadas à capacidade de uma substância de sofrer mudanças em sua composição durante reações químicas. Exemplos incluem reatividade com ácidos, bases e oxigênio, além de propriedades como acidez e basicidade.
Propriedades Físicas
Ponto de fusão e ebulição: O ponto de fusão mudança de sólido para líquido. Ponto de ebulição é a mudança de líquido para gás.
Exemplo: Água (H₂O): Ponto de fusão a 0 °C e ponto de ebulição a 100 °C.
Densidade: Relação entre a massa e o volume de uma substância. Densidade = Massa/Volume.
Exemplo: Água: 1 g/cm³; Etanol: 0,789 g/cm³ (menos denso que a água).
Solubilidade: A capacidade de uma substância se dissolver em um solvente.
Exemplo: Sal (NaCl) é solúvel em água, enquanto óleo não é solúvel em água.
Ductilidade: A capacidade de um material ser estirado em fios finos sem se romper.
Exemplo: Cobre (Cu) é altamente ductil e é usado em fios elétricos. Esponja de aço.
Maleabilidade: A capacidade de um material ser moldado em chapas ou formas sem quebrar.
Exemplo: Ouro (Au) é altamente maleável e pode ser martelado em folhas finas.
Condutividade Elétrica: A capacidade de uma substância de conduzir eletricidade, geralmente associada à presença de íons.
Exemplo: Água do mar é condutora devido à presença de sais dissolvidos, enquanto água destilada tem baixa condutividade.
Condutividade Térmica: A capacidade de uma substância conduzir calor.
Exemplo: Metais como cobre e alumínio possuem alta condutividade térmica, enquanto madeira e plástico têm baixa condutividade.
Propriedades Químicas
Inflamabilidade: A facilidade com que uma substância pega fogo e queima.
Exemplo: Acetona e etanol são inflamáveis, enquanto água não é.
Reatividade: A tendência de uma substância reagir com outras, formando novos produtos.
Exemplo: O sódio (Na) reage violentamente com água, enquanto o ouro (Au) é bastante inerte.
Toxicidade: A capacidade de uma substância causar efeitos adversos à saúde.
Exemplo: O cianeto de hidrogênio (HCN) é altamente tóxico e pode causar morte em pequenas quantidades.
Volatilidade: A tendência de uma substância evaporar rapidamente à temperatura ambiente.
Exemplo: Acetona e etanol são voláteis, enquanto o óleo mineral tem baixa volatilidade.
Combustibilidade: A capacidade de uma substância queimar em presença de oxigênio.
Exemplo: Gasolina é altamente combustível, enquanto a água não queima.