Ácido e base
Atualizado em 30 de maio de 2024
Ácidos e bases são dois tipos fundamentais de substâncias químicas que desempenham papéis cruciais em diversos processos químicos e biológicos.
Ácidos
Definição
- Ácidos são substâncias que, em solução aquosa, liberam íons hidrogênio (H⁺).
- De acordo com a definição de Brønsted-Lowry, ácidos são doadores de prótons (H⁺).
Propriedades
- Têm sabor azedo (por exemplo, o ácido cítrico em limões).
- Podem conduzir eletricidade em solução aquosa devido à presença de íons.
- Reagem com bases para formar sal e água (reação de neutralização).
- Mudam a cor de indicadores (por exemplo, tornam o papel de tornassol vermelho).
Exemplos Comuns
- Ácido clorídrico (HCl): Presente no suco gástrico.

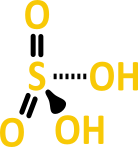
- Ácido sulfúrico (H₂SO₄): Amplamente utilizado na indústria.
- Ácido acético (CH₃COOH): Encontrado no vinagre.
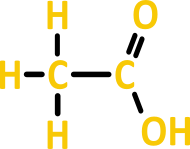
- Ácido cítrico (C₆H₈O₇): Encontrado em frutas cítricas como limões e laranjas.
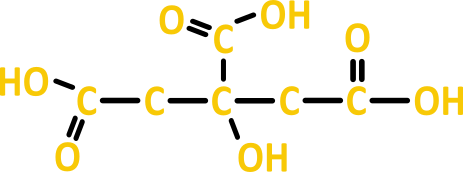
Bases
Definição
- Bases são substâncias que, em solução aquosa, liberam íons hidróxido (OH⁻).
- Segundo Brønsted-Lowry, bases são aceitadoras de prótons (H⁺).
Propriedades
- Têm sabor amargo e textura escorregadia (por exemplo, soluções de sabão).
- Também conduzem eletricidade em solução aquosa.
- Reagem com ácidos para formar sal e água (reação de neutralização).
- Mudam a cor de indicadores (por exemplo, tornam o papel de tornassol azul).
Exemplos Comuns
- Hidróxido de sódio (NaOH): Também conhecido como soda cáustica.

- Hidróxido de potássio (KOH): utilizado como matéria prima para fabricação medicamentos, fertilizantes e produtos de limpeza.

- Amônia (NH₃): Encontrado em produtos de limpeza.

Escala de pH
A acidez ou basicidade de uma solução é medida pela escala de pH, que varia de 0 a 14.
- pH < 7: solução ácida
- pH = 7: solução neutra
- pH > 7: solução básica (alcalina)
Teorias Ácido-Base
Arrhenius
- Ácidos liberam H⁺ em solução aquosa.
- Bases liberam OH⁻ em solução aquosa.
Brønsted-Lowry
- Ácidos são doadores de prótons.
- Bases são aceitadores de prótons.
Lewis
- Ácidos são aceitadores de pares de elétrons.
- Bases são doadores de pares de elétrons.
Importância dos Ácidos e Bases
Biologia: São essenciais para muitos processos biológicos, como a digestão.
Indústria: Amplamente utilizados na produção de produtos químicos, fertilizantes, detergentes, entre outros.
Medicina: Desde medicamentos até tratamentos médicos, os ácidos e bases desempenham papéis importantes.
Meio Ambiente: Podem influenciar a qualidade da água e do solo.
Questão sobre Ácido e base
CAPÍTULO29