Escala de pH e cálculos de pH em soluções
Atualizado em 31 de maio de 2025
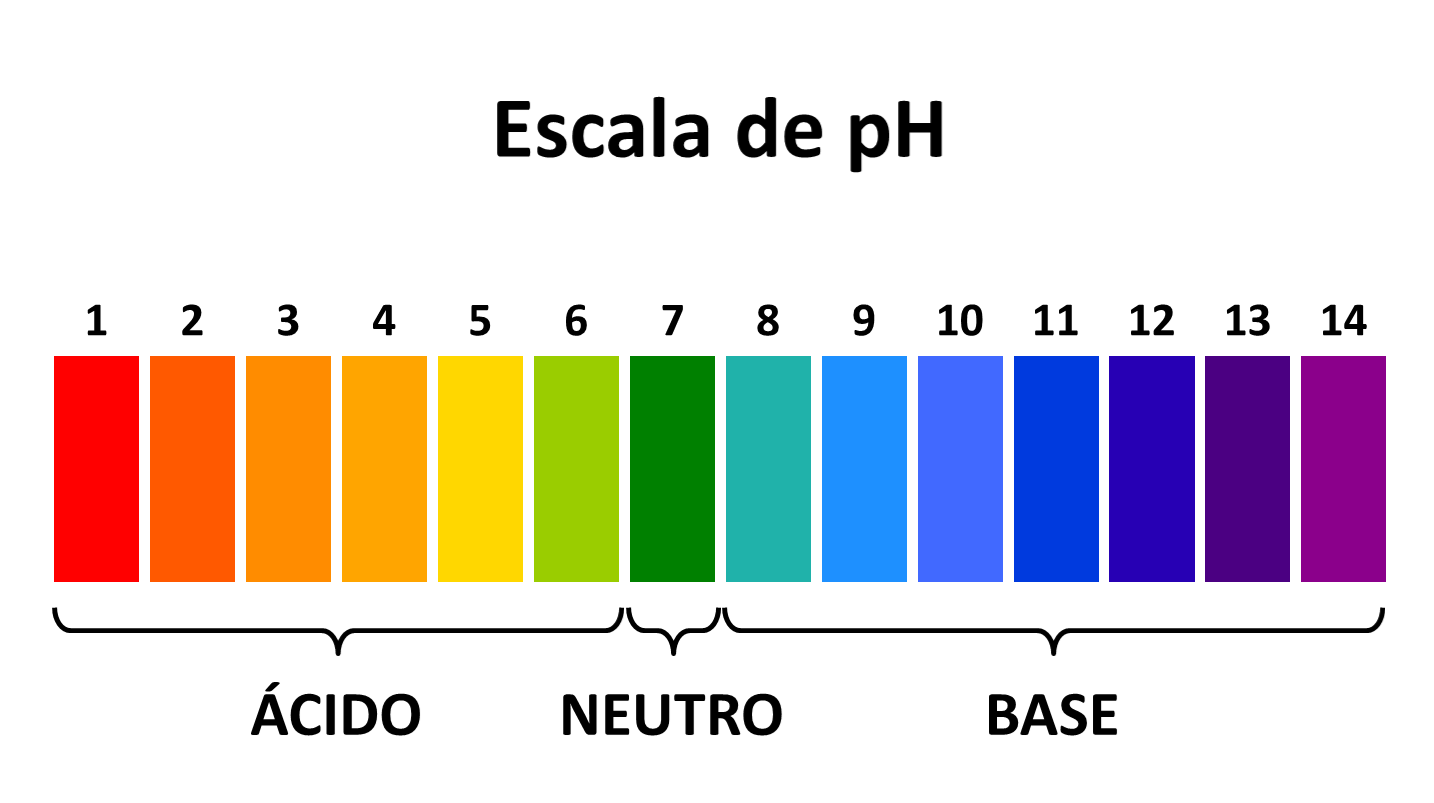
O pH é uma medida que indica a acidez ou basicidade de uma solução aquosa. Ele varia em uma escala logarítmica, geralmente de 0 a 14, onde:
pH < 7 → Solução ácida
pH = 7 → Solução neutra
pH > 7 → Solução básica (alcalina)
O pH é determinado pela concentração de íons hidrogênio ([H⁺]) em uma solução. Quanto maior a concentração de [H⁺], mais ácida é a solução.
Fórmula do pH
O pH é calculado usando a seguinte equação:
pH=−log[H+]
Onde:
[H⁺] = concentração de íons hidrogênio em mol/L
Log = Logaritmo (log = base 10)
Relação Fundamental entre pH e pOH
Além do pH, existe o pOH, que mede a concentração de íons hidroxila ([OH⁻]). Em qualquer solução aquosa a 25°C, vale a seguinte equação:
pH + pOH = 14
Exemplo I
Se uma solução tem [H⁺] = 2 . 10-5 mol/L, seu pH será:
Dados: log210 = 0,3, log1010 = X
Resolução:
pH =−log10[H+]
pH = −log210 . 10-5
pH = −log210 + log1010-5
pH = - (0,3 - 5)
pH = -(-4,7)
pH = + 4,7
Questão sobre Escala de pH e cálculos de pH em soluções